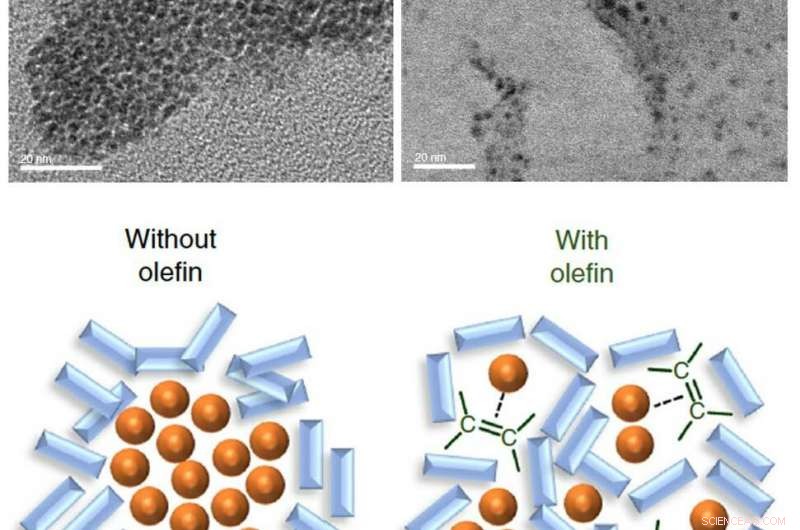
En haut :Images au microscope électronique de nanoparticules de palladium dans les mélanges réactionnels. Après 99 minutes de réaction, le catalyseur au palladium a été trouvé agrégé et s'est désactivé (à gauche) tandis que l'ajout d'oléfine a maintenu le catalyseur dispersé (à droite). En bas :illustration schématique montrant la fonction de l'oléfine en tant que dispersant. Crédit :Kubota K. et al., Communication Nature, 10 janvier 2019
Une réaction de couplage croisé est généralement effectuée dans un solvant organique et conduit à la production d'une grande quantité de déchets de solvant, ce qui est souvent nocif pour l'environnement. Une nouvelle stratégie développée par des chercheurs de l'Université d'Hokkaido au Japon ouvre la porte à des procédés de couplage croisé à l'état solide sans solvant plus respectueux de l'environnement utilisant la mécanochimie. Il a également de nombreuses applications potentielles, y compris le développement de matériaux organiques trouvés dans les cellules solaires et les diodes électroluminescentes.
Les réactions de couplage croisé se déroulent efficacement en présence d'un catalyseur métallique pour former une large gamme de molécules organiques avec de nouvelles propriétés. En particulier, les réactions de couplage croisé catalysées par le palladium, lauréates du prix Nobel, sont utilisées depuis longtemps dans la synthèse de produits naturels, en chimie médicinale, et en science des polymères et des matériaux.
Pour réduire les déchets environnementaux, les chercheurs ont étudié des méthodes pour permettre des synthèses organiques efficaces qui utilisent moins ou pas de solvant. Dans ce contexte, les "transformations organiques à l'état solide" ont fait l'objet d'une attention considérable de la recherche, mais l'amélioration de l'efficacité des réactions de couplage croisé dans les milieux solides reste un défi.
Dans une étude publiée dans Communication Nature , les chimistes organiques de l'Université d'Hokkaido Koji Kubota, Hajime Ito et leurs collègues ont développé une nouvelle stratégie pour les réactions de couplage croisé catalysées au palladium à l'état solide en utilisant la mécanochimie qui permet une synthèse efficace sans solvant de matériaux organiques.
Deux matières organiques solides ont été placées à l'intérieur d'un bol de broyage à boulets qui contient une boule de broyage en acier inoxydable. Un catalyseur à base de palladium a également été ajouté. Le pot subit un processus d'agitation qui amène la boule à broyer les composés solides, initier une réaction de couplage croisé.
Ils ont constaté que le catalyseur à base de palladium avait tendance à s'agréger pendant la réaction, ce qui peut conduire à la désactivation du catalyseur. Mais, lorsqu'une oléfine telle que 1, Du 5-cyclooctadiène a été ajouté au mélange, il a agi comme un dispersant pour le catalyseur à base de palladium, facilitant une réaction de couplage croisé à l'état solide plus efficace. Lorsque l'oléfine a été ajoutée, le taux de conversion de la réaction est passé de moins de 30 % à 99 %.
« Notre protocole devrait être particulièrement utile pour réduire la quantité de solvant organique utilisé dans l'industrie qui est nocif pour l'environnement. Il rendra également le processus de production moins coûteux, " a déclaré Hajime Ito. " La nouvelle méthode pourrait être appliquée à, par exemple, la production de triarylamines que l'on peut trouver dans une large gamme de matériaux organiques, notamment les cellules solaires et les diodes électroluminescentes.