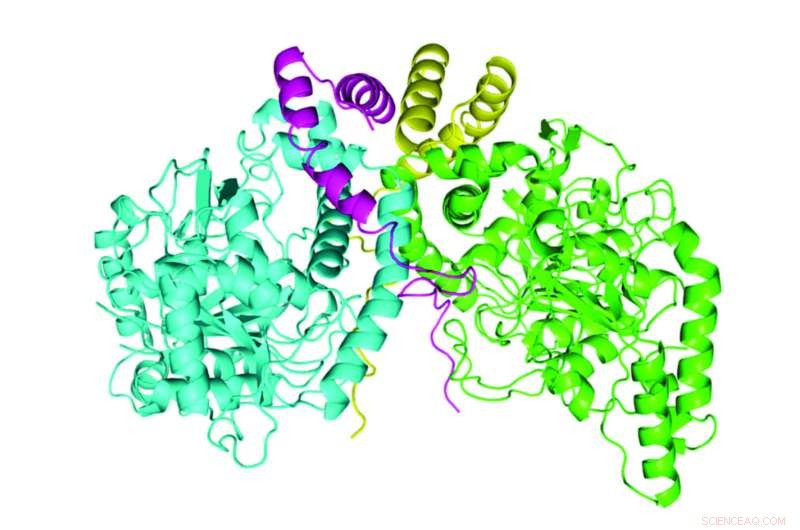
Un complexe protéique nouvellement décrit réalise une étape de dégradation bactérienne de l'herbicide atrazine. Les deux molécules AtzE sont en bleu et vert et les deux molécules AtzG sont en jaune et magenta. Crédit :Colin Scott, CSIRO
Atrazine, un herbicide controversé introduit en agriculture dans les années 1950, a été interdit dans l'Union européenne, mais est largement utilisé aux États-Unis et en Australie. Au cours des décennies où l'atrazine s'est accumulée dans les champs agricoles, certaines bactéries de ces sols ont développé la capacité de tirer parti de ce composé riche en azote, le métaboliser et l'utiliser pour grandir.
Chercheurs de l'Organisation de recherche scientifique et industrielle du Commonwealth d'Australie, ou CSIRO, sont intéressés à exploiter la capacité des bactéries à dégrader l'atrazine afin d'assainir les environnements pollués par l'atrazine. Dans un nouveau document de recherche publié dans le Journal de chimie biologique , une équipe du CSIRO et de l'Australian National University décrivent des protéines auparavant inconnues impliquées dans la dégradation de l'atrazine - et les informations que celles-ci peuvent nous donner sur la façon dont les bactéries développent de nouvelles capacités en réponse aux produits chimiques synthétisés par les humains. exploiter de nouvelles sources de nutriments, et ils le font en adaptant la machinerie cellulaire existante pour de nouvelles fonctions, " dit Colin Scott, le chef de l'équipe de biocatalyse et de biologie synthétique du CSIRO, qui a supervisé les travaux.
Transformer l'atrazine en une source d'azote utilisable est un processus en plusieurs étapes pour les bactéries, impliquant plusieurs enzymes. Chacune de ces enzymes avait auparavant rempli des fonctions différentes dans les cellules bactériennes du monde avant la pollution généralisée de l'atrazine. Chez les bactéries dégradant l'atrazine, les gènes codant pour ces enzymes sont regroupés sur une section d'ADN appelée plasmide, qui peut facilement être transmis entre les bactéries, en leur donnant une nouvelle adaptation toute faite.
"Dans les 10 ans qui ont suivi sa découverte originale (dans les années 1990), les gènes de cette voie ont été trouvés (dans les bactéries) sur à peu près tous les continents, à l'exception de l'Antarctique, " dit Scott. En d'autres termes, à mesure que l'utilisation de l'atrazine s'est répandue dans le monde entier, il en va de même pour la capacité bactérienne de le métaboliser.
Alors que les enzymes impliquées dans plusieurs de ces étapes ont été décrites en détail, la structure de l'un d'eux, appelé AztE, était encore inconnu. L'AztE est crucial pour convertir un acide cyanurique - une étape intermédiaire dans le processus de dégradation de l'atrazine - en ammoniac.
Lygie Esquirol, un doctorat étudiant dans le laboratoire de Scott, a mené l'effort pour purifier cette protéine. Lorsque l'équipe a examiné la protéine, il a trouvé quelque chose de surprenant :un autre, très petite protéine, dont l'existence n'avait pas été prédite à partir de la séquence du génome de la bactérie, formant un complexe avec AztE. Cette nouvelle protéine, que l'équipe a nommé AztG, semblait nécessaire pour stabiliser la structure d'AztE.
Ensemble, la structure de l'AztE et de l'AztG ressemblait à un complexe protéique bactérien différent :le transamidasome, qui aide à fabriquer l'ARN de transfert bactérien. Ainsi, il est apparu que les protéines impliquées dans les fonctions de base de la cellule bactérienne étaient ré-outillées pour la nouvelle voie de l'atrazine.
"(Le transamidasome) est absolument essentiel pour les bactéries dans la façon dont elles fabriquent leurs ARNt, " dit Scott. " C'était quelque peu surprenant que notre protéine, qui est impliqué dans le catabolisme des pesticides, était (similaire) à ce complexe protéique qui est utilisé dans le métabolisme central."
La promesse de la biologie synthétique est que les humains peuvent combiner des gènes codant différentes fonctions dans un organisme de manière créative. Cependant, bien qu'il soit relativement simple d'insérer des gènes dans de nouveaux contextes, il n'y a pas toujours une garantie qu'un sentier nouvellement construit fonctionnera comme prévu. Il est donc instructif d'examiner des voies comme la voie de dégradation de l'atrazine, dans lequel les bactéries ont réutilisé avec succès une série de gènes non apparentés pour faire quelque chose de nouveau.
"Ce (chemin) est venu d'autres endroits et a été bricolé, mais il doit y avoir des règles et des contraintes sous-jacentes sur la façon de le faire, " a déclaré Scott. "Nous ne savons pas pour le moment quelles sont les règles de conception pour les voies complexes en termes d'architecture génétique. Ce que nous voulons faire, c'est utiliser la voie de l'acide cyanurique comme modèle pour comprendre certains de ces principes de conception. »
Les bactéries dégradant l'atrazine convertissent l'atrazine en composés azotés que les plantes pourraient potentiellement utiliser comme engrais, mais cela pose ses propres problèmes :le ruissellement d'azote dans l'eau provoque des proliférations d'algues et la mort d'animaux. Ainsi, L'un des problèmes clés que les chercheurs du CSIRO tentent de résoudre est de savoir comment contenir la réaction afin qu'elle se produise uniquement où et comment les humains en ont besoin. Une approche consiste à utiliser une application ciblée d'enzymes purifiées à partir de ces bactéries, plutôt que les bactéries elles-mêmes.
« En tant que technologie, nous sommes allés sur le terrain et avons prouvé que (les enzymes) peuvent fonctionner, " a déclaré Scott. " La prochaine étape consiste à travailler avec l'industrie pour essayer de mettre en œuvre certaines de ces solutions. "