
Fonctionnalisation des liaisons éther. (A) Médicaments à petites molécules contenant des fragments d'éther cycliques. Ph, phényle; Ac, acétyle; Bz, benzoyle; glu, glucose. (B) Clivage C−O catalysé par un métal de transition via une addition oxydante. R, alkyle; M, métal de transition; FG, groupe fonctionnel; B2pin2, bis(pinacolato)diboron. (C) Insertion de carbène dans des éthers activés. (D) Dérivés de boronate cyclique en tant que candidats-médicaments ou agents de réticulation pour les matériaux biomédicaux. (E) Ce travail :une insertion directe de bore catalysée par Ni via une voie de clivage puis de rebond. Crédit :Sciences, 10.1126/science.abg5526
La liaison carbone-oxygène (C-O) dans les éthers alkyliques peut être clivée à l'aide de méthodes douces pour simplifier les synthèses chimiques en élaborant des précurseurs facilement disponibles. Dans un nouveau rapport maintenant sur Science , Hairong Lyu et une équipe de recherche en chimie de l'Université de Chicago et de l'Université de Pittsburgh, Les États-Unis ont expliqué en détail comment les dibromoboranes réagissaient avec les éthers d'alkyle en présence d'un catalyseur au nickel (Ni) et d'un réducteur de zinc pour insérer du bore dans la liaison C-O. La réactivité subséquente a affecté la substitution oxygène-azote pour rationaliser la préparation de composés bioactifs plus largement. À l'aide d'études mécanistes, l'équipe a révélé une voie de clivage puis de rebond via une catalyse en tandem zinc/nickel.
fractions d'éther
Les fractions éther se trouvent couramment dans les matières premières et les produits chimiques fins; par exemple, les éthers cycliques sont répandus dans une gamme de molécules biologiquement importantes, y compris les médicaments, agrochimiques et produits naturels. Les éthers agissent également comme des lieurs structuraux efficaces pour protéger les groupes dans la synthèse organique en raison de leur grande stabilité chimique vis-à-vis des acides, socles, réducteurs et oxydants. Une méthode douce qui modifie directement une fraction en remplaçant l'oxygène ou en insérant un atome intermédiaire dans la liaison C-O peut commodément introduire un nouveau groupe fonctionnel dans un échafaudage existant dans une étape stratégiquement importante. Les chimistes peuvent utiliser des éthers robustes comme substituts pour des groupes chimiques plus sensibles qui peuvent être installés plus tard. Lyu et al. ont été inspirés par les progrès récents de la chimie du borylène pour fonctionnaliser les liaisons éther en insérant une espèce borylène active.
Clivage des liaisons éther alkylique
Classiquement, les liaisons alkyléther peuvent être clivées dans des conditions difficiles et fortement acides. Pour établir une méthode pratique dans ce travail, Lyu et al. cherché à éviter les réducteurs forts, catalyseurs coûteux et conditions de réaction forcée. L'étude a donc commencé avec 2, 3-dihydrobenzofurane comme sous-état éther modèle et dibromomésitylborane (MesBBr
Borylation d'éthers cycliques catalysée par le nickel. (A) Synthèse d'oxaborinanes par borylation directe d'éthers cycliques à cinq chaînons. Moi, méthyle; Ar, aryle. (B) Synthèse d'oxaborepans par borylation directe d'éthers cycliques à six chaînons. Ts, tosyle. (C) Synthèse d'oxaborolanes et d'azaborolidine par borylation directe de cyclooxabutanes et d'azétidine. (D) Synthèse de l'oxazaborolidine par borylation directe de la 4-phényl-morpholine. (E) Synthèse d'acides boriniques par borylation directe d'éthers linéaires. Les réactions ont été conduites avec 0,2 mmol d'éther, 0,24 mmol MesBBr2, 0,01 mmol Cat 1, et 1 mmol de poudre de zinc dans 0,5 ml de toluène à 60°C sous azote pendant 24 heures. Les rendements isolés après chromatographie sur gel de silice sont donnés; les nombres entre parenthèses sont les rendements de résonance magnétique nucléaire avant purification. *La réaction a été effectuée à 80°C. La réaction a été effectuée à 100°C. 0,2 mmol de MesBBr2 a été utilisé. § La réaction a été effectuée à 130°C. ¶Ni (PMe3)2Cl2 (0,01 mmol) a été utilisé comme catalyseur, et la réaction a été conduite à 130°C pendant 18 heures. Le temps de réaction était de 36 heures. Crédit :Sciences, 10.1126/science.abg5526 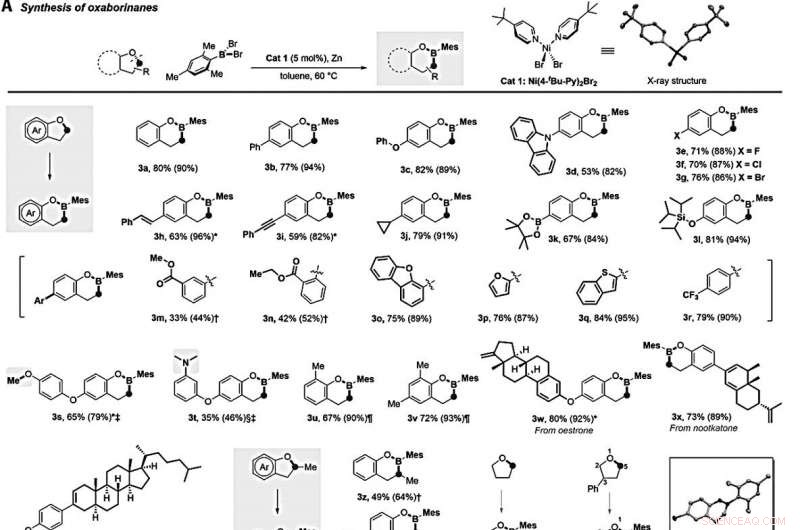
Lyu et al. examiné la portée de l'éther pour la réaction d'insertion du bore. Par exemple, une plage de 2 substitués, 3-dihydrobenzofuranes réagis avec MesBBr
Insertion de bore dans des molécules plus complexes.
Lyu et al. insertion supplémentaire de bore dans des oxétanes plus tendus, également, pour fournir une entrée aux oxaborolanes à cinq chaînons (étiquetés 3ai à 3aj). La sélectivité compromise a entraîné des produits secondaires linéaires. Du point de vue de la praticité synthétique, l'équipe a montré comment la liaison B-Mes (bore-mésityle) pouvait facilement subir une hydrolyse en un seul récipient via l'ajout d'eau dans du méthanol pour fournir les produits de boronate d'hydroxyle correspondants qui sont plus stables dans l'air. Les scientifiques ont fonctionnalisé des boronates cycliques à partir de 2 facilement disponibles, 3-dihydrobenzofuranes en une seule étape pour développer des analogues d'un médicament antifongique approuvé connu sous le nom de tavaborole et crisaborole, un médicament approuvé pour traiter la dermatite.
Élaboration synthétique. (A) Accès rapide aux boronates cycliques via hydrolyse en un seul pot. Les produits de boronate (5a à 5c) sont sensiblement plus stables vis-à-vis de l'air et de l'humidité. (B) Fonctionnalisation supplémentaire du produit de borylation par dérivatisation de la liaison C-B. Bn, benzyle. (C) Édition O-à-N pour accéder aux pyrrolidines et pipéridines des tétrahydrofuranes et tétrahydropyranes, respectivement. (D) Trois approches pour l'expansion du cycle à un carbone des éthers cycliques. DIADE, l'azodicarboxylate de diisopropyle. (E) Synthèse simplifiée du médicament antihypertenseur nébivolol. Pour des protocoles de réaction détaillés. Crédit :Sciences, 10.1126/science.abg5526
Autres réactions
Le fragment bore dans les produits d'insertion pourrait également être commodément converti en divers autres groupes fonctionnels. Par exemple, l'équipe a pu traiter le produit brut (3a) 2H-benzoxaborine, avec du peroxyde d'hydrogène pour obtenir 1, 2-tyrosol (6a) avec un excellent rendement. Le couplage Suzuki-Miyaura de la molécule 3a avec le bromo-benzène a formé efficacement l'o-phénéthylphénol (étiqueté 7a). La méthode a également permis des réactions d'expansion de cycle à un carbone efficaces et a fourni une expansion de cycle à rétention de bore. Lors des expérimentations, la nature du groupe alkyle dans la réaction de couplage et le rôle du catalyseur au nickel ont été essentiels pour comprendre les étapes ultérieures de la formation de liaisons carbone-bore.
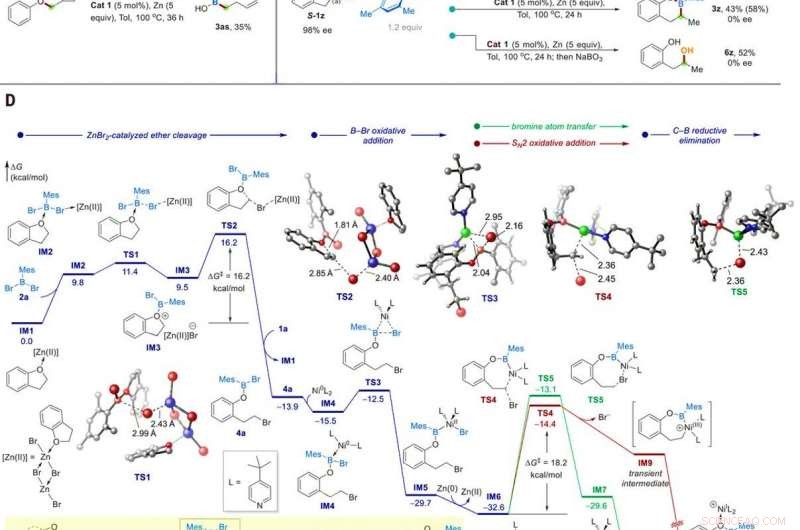
Études mécanistiques. (A) Identification de l'intermédiaire de réaction. (B) Expérience d'horloge radicale. (C) Expériences de contrôle avec un substrat ee à 98%. (D) Profil énergétique calculé de la borylation catalytique de l'éther 1a. Les calculs ont été effectués au M06/SDD-6311+G(d, p)/SMD(toluène)//B3LYP-D3/SDD-6-31G(d) niveau théorique. L'encart montre la catalyse en tandem Zn/Ni proposée. Crédit :Sciences, 10.1126/science.abg5526
Perspectives
De cette façon, Hairong Lyu et ses collègues ont démontré une méthode d'insertion du bore dans les liaisons éther alkylique sous la catalyse du nickel et du zinc. Étant donné que les éthers sont des sous-états facilement disponibles et robustes, la méthode d'insertion de bore peut également rationaliser la synthèse de molécules cibles complexes en minimisant les manipulations de groupes fonctionnels ou en protégeant les utilisations des groupes. Le mode de réaction distinct révélé par les études mécanistes peut avoir des implications sur les réactions de catalyse en tandem acide de Lewis/métal de transition qui dépassent ce travail.
© 2021 Réseau Science X