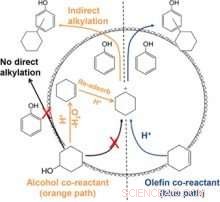
L'alkylation du phénol avec le cyclohexanol (chemin orange) se produit après que la majorité du cyclohexanol est déshydratée en cyclohexène. La raison pour laquelle le mécanisme suit cette voie n'est pas due à un accès limité au cyclohexanol, c'est plutôt dû à l'absence d'un électrophile réactif lorsqu'une grande fraction de cyclohexanol est présente. Crédit :Société chimique américaine
De l'essence, lubrifiants, et les produits de consommation sont améliorés par des additifs chimiques. La fabrication d'additifs implique souvent une réaction chimique connue sous le nom d'alkylation, l'ajout d'une chaîne carbonée aux molécules existantes. Les chimistes savent que les catalyseurs acides sont utiles pour l'alkylation, mais comment l'un des catalyseurs les plus populaires, zéolithes acides, effectuer une alkylation dans une phase condensée n'est pas bien compris.
Jian Zhi Hu, Zhenchao Zhao, Hui Shi, Johannes Lercher, et leurs collègues du Pacific Northwest National Laboratory ont identifié un mécanisme de réaction clé associé à l'alkylation catalysée par la zéolite du phénol avec le cyclohexanol. Ils ont fait cette découverte en utilisant la spectroscopie in situ de résonance magnétique nucléaire (MAS-RMN) à haute température et haute pression.
Les scientifiques ont maintenant compris comment l'activité catalytique, mécanisme, et les voies de réaction dépendent de trois facteurs. Ces facteurs sont la concentration et la force des sites acides, les contraintes stériques de la réaction, et l'identité de l'agent d'alkylation.
Des analyses cinétiques et spectroscopiques détaillées ont montré que l'alkylation du phénol avec le cyclohexanol ne se produit pas de manière appréciable avant qu'une majorité de cyclohexanol n'ait été déshydratée en cyclohexène. Les réactions d'alkylation sont ralenties tant que l'alcool est présent. En revanche, des produits d'alkylation se forment facilement lorsque la solution ne contient initialement que du phénol et du cyclohexène.
Une combinaison de spectroscopie MAS-RMN in situ et l'utilisation de phénol et de cyclohexanol enrichis en isotopes de carbone 13 ont permis l'identification de la voie de réaction qui est difficile à sonder par d'autres méthodes de spectroscopie. La séquence de réaction ne se produit pas à la suite d'une adsorption compétitive mais par l'absence d'un électrophile réactif. Ceci est dû à la formation préférentielle de complexes d'adsorption, c'est à dire., dimères d'alcools protonés sur les sites acides de Brønsted, qui entravent l'adsorption du cyclohexène. A faible couverture des sites acides par des dimères protonés, l'adsorption et la protonation du cyclohexène produisent des ions cyclohexyl carbénium, qui attaquent le phénol pour produire des produits alkylés. Cela implique en outre que les dimères de cyclohexanol protonés se déshydratent sans formation d'ions carbénium.
Les résultats montrent l'importance de la spectroscopie RMN en tant que méthode analytique in situ unique, fournissant des informations moléculaires détaillées sur l'échantillon étudié dans des conditions réelles (operando).
« Des experts en catalyse et en RMN ont collaboré pour nous permettre de surveiller d'importants processus chimiques se produisant à des températures et des pressions élevées, " a déclaré Karl Mueller, Directeur scientifique et technologique du PNNL pour les sciences physiques et informatiques. "Avant, nous devions déduire ce qui se passait en arrêtant la réaction (c'est-à-dire, ex situ) ou en mesurant uniquement les produits finis, ni l'un ni l'autre ne peut nous montrer une image complète."
Avec des informations sur les voies de réaction cruciales et sur la contribution de la spectroscopie RMN, l'équipe continue d'explorer de nouvelles réactions et catalyseurs pour produire des vecteurs énergétiques, ou des molécules qui stockent de l'énergie dans les liaisons chimiques.