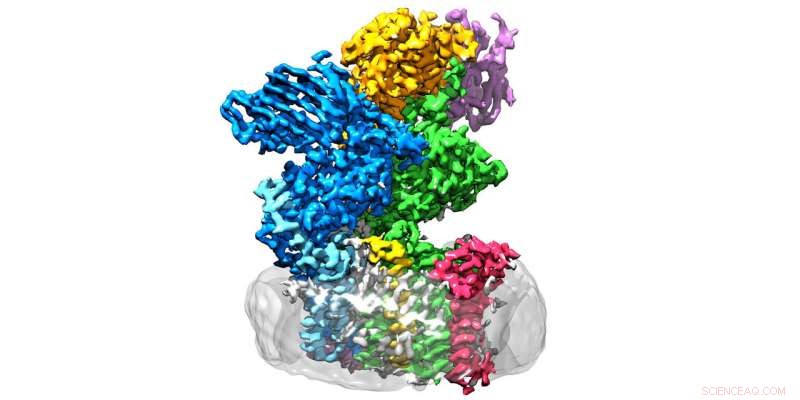
L'enzyme oligosaccharyltransférase est située dans la membrane (gris) et se compose de huit sous-unités. Crédit :Julia Kowal / ETH Zurich
Des chercheurs de l'ETH ont réussi à déterminer la structure 3-D de l'enzyme qui attache les chaînes de sucre aux protéines - une percée qu'ils ont récemment publiée dans la revue Science .
Chaque fois que les cellules reçoivent des signaux, interagir avec d'autres cellules ou identifier des virus et des bactéries, le processus implique non seulement des protéines mais aussi des chaînes de sucre attachées à leur surface. L'objet de relativement peu d'attention jusqu'à présent, ces structures diffèrent largement par la composition et la ramification, et semblent aider à garantir que les protéines se replient correctement et sont capables d'effectuer leurs tâches spécifiques.
Plusieurs observations démontrent l'importance des appendices sucrés :des protéines identiques avec des chaînes de sucre différentes ont des fonctions différentes, les cellules malades et saines ont des compositions de sucre différentes à leur surface, et les médicaments auxquels ils sont attachés sont apparemment mieux tolérés.
Comment le sucre se mêle-t-il aux protéines ?
Connu sous le nom de glycanes, ces substances font actuellement l'objet de recherches intensives. Après la génomique et la protéomique, il y a maintenant aussi la glycomique. Le domaine de recherche émergent de la glycobiologie traite de la biosynthèse, structure et les diverses fonctions des appendices sucrés. Une question clé est de savoir comment l'ensemble diversifié de molécules de sucre atteint les protéines en premier lieu.

Images au microscope cryoélectronique de l'enzyme. Crédit :Rebekka Wild / ETH Zurich
Les chercheurs de l'ETH dans les groupes dirigés par Kaspar Locher de l'Institut de biologie moléculaire et de biophysique et Markus Aebi de l'Institut de microbiologie ont désormais franchi une étape décisive dans ce domaine :ils ont déterminé la structure tridimensionnelle de l'oligosaccharyltransférase (OST) dans Levure. "C'est l'enzyme qui relie les protéines aux arbres à sucre, " explique Rebekka Wild, l'un des trois principaux auteurs du rapport en Science dans laquelle les chercheurs de l'ETH présentent leurs découvertes.
Déterminer la structure de l'OST n'a pas été facile :au départ, Jilliane Eyring, le troisième auteur principal du rapport, modifié les cellules de levure afin que l'enzyme puisse être ciblée et purifiée. Wild a d'abord dû extraire l'enzyme, qui est noyé dans une membrane dans la cellule, à partir de grandes quantités de ces cellules de levure, puis les purifier au cours d'une procédure laborieuse. " Neuf litres de levure ont produit environ 0,2 milligramme d'enzyme, " dit-elle. Les molécules OST ont été appliquées à une petite grille, surgelé en tant qu'individu, particules séparées et imagées à l'aide d'un microscope cryoélectronique à haute résolution.
Cela a donné lieu à des milliers d'images montrant le complexe enzymatique sous tous les angles de vue possibles. A partir de ces images, Julia Kowal, le deuxième auteur principal, généré la structure tridimensionnelle de l'OST. Il a fallu six semaines pour effectuer les calculs sur le cluster d'ordinateurs. Le résultat était une carte de densité électronique qui montre l'enzyme comme un "nuage d'électrons".
"Nous avons profité d'un moment de chance, » explique Wild. Ils ont pu profiter de la « révolution de la résolution » en cours en microscopie cryo-électronique et utiliser un appareil de pointe à résolution atomique. Le développement de cette technologie a été récompensé par le prix Nobel. en chimie en 2017.
Afin d'interpréter les données de microscopie électronique, Wild a dû adapter la séquence d'acides aminés de l'OST « manuellement » dans les petits nuages de la carte tridimensionnelle. Ainsi, le chercheur a pu décrire en détail la structure 3-D de l'OST - une percée qui a été accueillie avec plaisir par les chercheurs après sa publication en ligne.
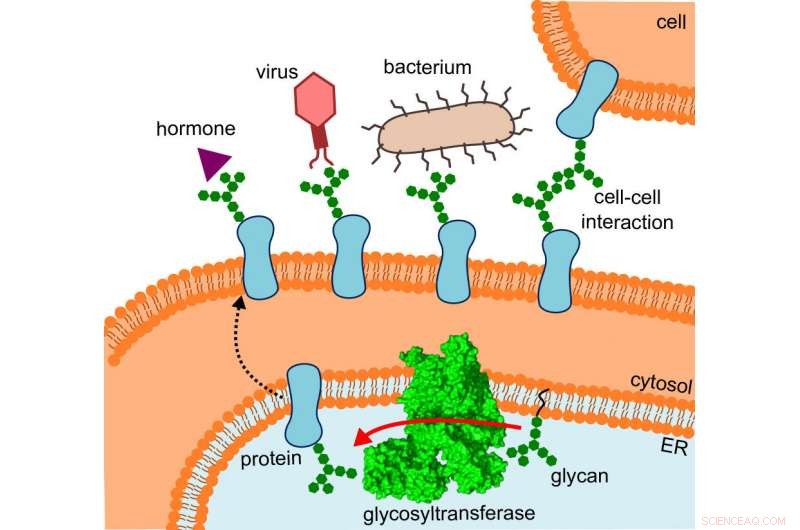
Le diagramme montre où se trouve la glycosyltransférase, la voie empruntée par les protéines altérées et les interactions qu'elles subissent. Crédit :R. Wild / ETH Zurich
L'OST est un complexe protéique membranaire composé de huit sous-unités, qui identifient, par exemple, les substrats sucrés ou protéiques ou stabiliser l'unité catalytique. Ce dernier est la sous-unité de l'enzyme qui abrite le centre actif, où les protéines et les sucres sont réunis et fusionnés. "Nous nous attendions à ce que l'unité catalytique soit au milieu de l'enzyme, " Wild explique. " Étonnamment, cependant, c'est à l'extérieur - et la forme rappelle une bouche grande ouverte."
Ce qui avait d'abord dérouté les chercheurs avait soudain du sens, car ils ont adapté la structure à l'emplacement où l'OST opère réellement :en particulier, l'enzyme est noyée in vivo dans la membrane du réticulum endoplasmique (RE). C'est la partie de la cellule où les protéines sont produites, plié, surveillé et modifié.
Ici, le voisin direct de l'OST est une protéine tunnel – cela était déjà connu. Cela achemine les protéines naissantes à l'intérieur du réticulum endoplasmique, puis directement dans la bouche grande ouverte de l'OST, où ils reçoivent leurs minuscules arbres à sucre.
"Levure OST est un bon modèle pour les processus chez l'homme, " explique Wild. Les chercheurs tirent cette conclusion du fait que le centre actif de la levure OST, où les protéines sont agrémentées de sucres, ressemble étroitement à la zone correspondante chez les bactéries. "Cela signifie que le centre actif a à peine changé au cours de l'évolution, " explique le chercheur, "ce qui signifie qu'il y a de fortes chances que cela fonctionne toujours de manière très similaire chez les mammifères, et donc aussi chez l'homme."