2 ) gaz est difficile car la forte liaison entre les atomes N est difficile à rompre.
Alors qu'une méthode pour produire du NH 3 à l'échelle industrielle, appelé procédé Haber-Bosch, existe depuis le début du 20ème siècle, l'approche la plus performante d'aujourd'hui implique l'utilisation de ruthénium, un métal cher et rare, comme catalyseur pour déclencher les réactions nécessaires. Récemment, Le professeur Hideo Hosono et ses collègues du Tokyo Institute of Technology (Tokyo Tech), Japon, ont développé une nouvelle stratégie pour produire NH 3 en utilisant du lanthane (La), un élément beaucoup plus abondant, en combinaison avec du nickel (Ni).
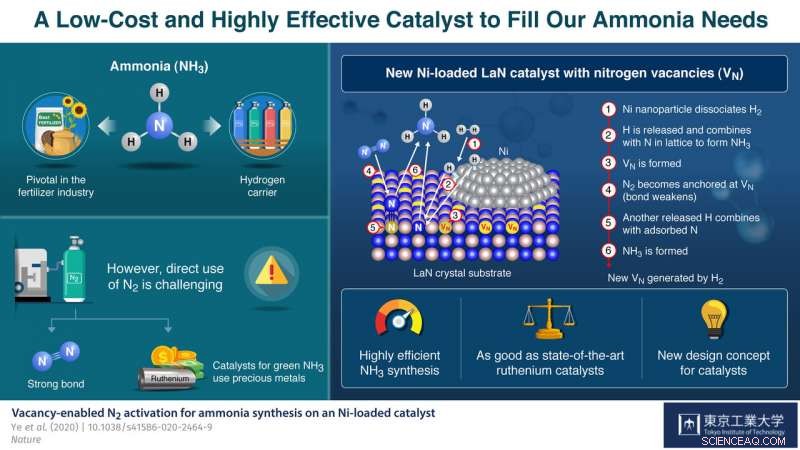
Dans leur papier, Publié dans La nature , ils expliquent comment ils se sont inspirés d'un NH précédemment rapporté 3 catalyseur de production de formule Co 3 Mo 3 N, qui porte des lacunes d'azote - des endroits où la présence d'un atome d'azote serait attendue mais qui sont en fait vides. Ces vacances ont été observées pour rendre la division de N 2 molécules plus faciles, qui a conduit l'équipe d'Hosono dans une nouvelle direction d'exploration pour un NH plus facilement disponible et plus efficace 3 catalyseurs de synthèse. Il explique :« Le rôle critique des lacunes d'azote dans le Co 3 Mo 3 N nous a inspirés à considérer d'autres matériaux contenant de l'azote sur lesquels des lacunes pourraient être facilement générées comme base pour de nouveaux catalyseurs à base de Ni.
Le catalyseur qu'ils ont développé est constitué de cristaux de LaN chargés de nanoparticules de Ni. Le Ni dissocie facilement H 2 en atomes H. Ainsi, prétraitement du catalyseur avec H 2 génère facilement des atomes H, qui réagissent ensuite avec les atomes N dans la structure cristalline pour former NH 3 et créer N postes vacants sur le support LaN. Chacun de ces sites vides capture alors un atome N d'un N 2 molécule de l'azote gazeux d'entrée, affaiblissant la liaison N-N de la molécule. Un autre atome H dissocié brise la liaison N-N affaiblie pour produire plus de NH 3 , laissant un atome N derrière pour combler la vacance d'origine. Ces cycles se répètent, générant ainsi en continu des lacunes d'azote et entretenant le processus de synthèse.
Ce concept de catalyseur "double site actif" s'est avéré très prometteur. Les performances du catalyseur proposé dépassent de loin celles des catalyseurs plus conventionnels à base de cobalt et de nickel et sont même comparables à celles des catalyseurs à base de ruthénium :il produit non seulement des rendements élevés d'ammoniac à température et pression modérées, sa structure est maintenue même après 100 heures de réaction continue, démontrant sa grande stabilité.
Hosono dit, « Nous prévoyons que nos travaux stimuleront une exploration plus approfondie de conceptions de catalyseurs utilisant des éléments plus abondants. En particulier, nos résultats illustrent le potentiel de l'utilisation de sites vacants dans les cycles de réaction et indiquent un nouveau concept de conception de catalyseurs pour la synthèse d'ammoniac."
La nouvelle stratégie pourrait rendre la production d'ammoniac plus simple et plus abordable, facilitant ainsi une multitude de processus industriels importants.