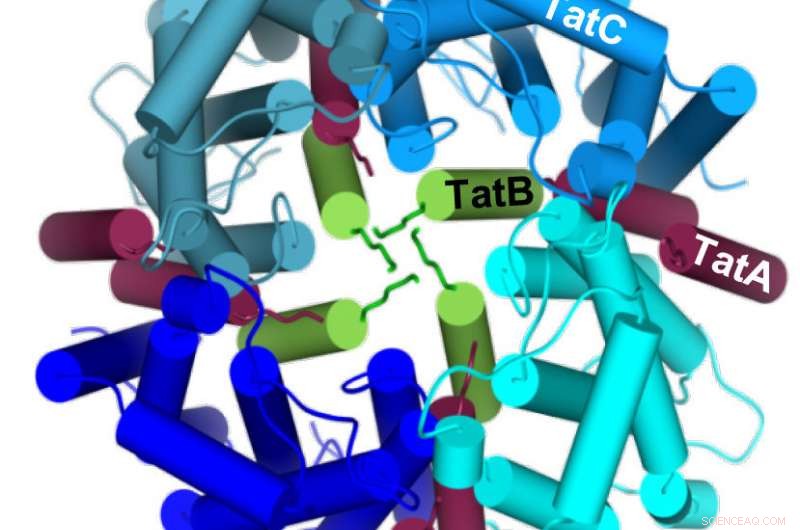
Quatre molécules TatC (bleues) créent un cercle autour de quatre molécules TatB (vert) pour former une cavité au centre dans laquelle la protéine à transporter peut s'insérer par le bas. Crédit: Journal de chimie biologique
Chaque cellule est entourée d'une membrane, qui assure le milieu biochimique interne et régule les échanges de substances avec son environnement. Dans chaque membrane cellulaire, il existe un grand nombre de transporteurs qui ne laissent passer qu'une seule sorte de molécule. Dans le cas de très petites molécules, comme l'eau, les transporteurs responsables forment de minuscules pores dans la membrane, qui disparaissent immédiatement après le processus. Mais comment des protéines mille fois plus grosses sont-elles transportées à travers les membranes sans créer de fuite importante ?
Dans une étude récente, une équipe dirigée par le Prof. Dr. Matthias Müller à l'Institut de Biochimie et de Biologie Moléculaire et le domaine de recherche spécial 746 avec le Prof. Dr. Bettina Warscheid à l'Institut de Biologie II et le Cluster of Excellence ESBIO Center for Biological Signalling Studies à l'Université de Fribourg a découvert des détails sur la structure d'un tel transporteur pour les molécules de protéines. Leurs conclusions ont été publiées dans Journal de chimie biologique .
Les chercheurs ont étudié le transporteur dit Tat qui existe dans la membrane cellulaire des bactéries et exporte certaines protéines, les substrats Tat, hors d'eux. Le transporteur se compose de trois composants appelés TatA, TatB et TatC. Ils sont répartis dans toute la membrane à l'état de repos et ne s'assemblent en un transporteur actif que lorsqu'un substrat de Tat se lie à TatC. Jusqu'à présent, on sait peu de choses sur la façon dont les trois composants fusionnent.
Dans une étude précédente, les chercheurs avaient découvert que le produit chimique dicyclohexylcarbodiimide (DCCD) bloquait le transport de Tat. Les scientifiques ont maintenant identifié une position spécifique sur TatC qui peut être modifiée chimiquement par DCCD, qui à son tour inhibe le contact avec le substrat Tat. La position n'est pas située sur la surface TatC, mais plutôt dans une partie cachée au plus profond de la membrane. Ainsi, DCCD n'inhibe pas l'amarrage primaire du substrat Tat, mais plutôt sa pénétration profonde dans la membrane le long de la molécule TatC. Ainsi, les équipes ont pu démontrer que l'assemblage de plusieurs composants TatC et TatB crée une cavité dans laquelle le substrat Tat s'insère d'un côté de la membrane. Ce n'est qu'à l'étape suivante, qui doit encore être expliqué, que cette cavité s'ouvre vers l'extérieur pour lequel TatA est alors nécessaire.
Le transporteur Tat pourrait servir à développer de nouveaux types d'antibiotiques à l'avenir :certaines bactéries nocives pour l'homme utilisent le transport Tat pour exporter des molécules protéiques à l'aide desquelles elles établissent le contact avec les cellules hôtes humaines. Idéalement, un antibiotique ne doit inhiber que le métabolisme des bactéries et non celui des patients. Étant donné que le transporteur Tat ne se produit pas dans les cellules humaines, ce serait donc une cible antibiotique appropriée.