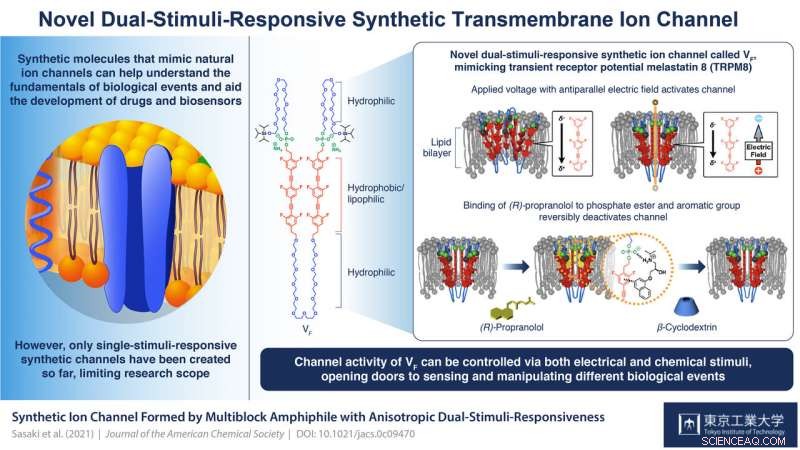
Un VF amphiphile multibloc a été développé. Lorsque la FV a été incorporée dans les membranes bicouches lipidiques, VF a formé un canal ionique supramoléculaire. La propriété de transport ionique de la FV pourrait être inversée de manière réversible par l'ajout de (R)-propranolol, une amine aromatique connue comme antiarythmique, suivi de l'ajout de -cyclodextrine pour son élimination. Crédit : Tokyo Tech
Scientifiques de l'Institut de technologie de Tokyo (Tokyo Tech) et de l'Université de Tokyo, Japon, ont, pour la première fois, synthétisé un nouveau canal ionique transmembranaire artificiel modelé sur un canal transmembranaire naturellement présent impliqué dans la signalisation neuronale, qui répond à la fois aux stimuli chimiques et électriques. Compte tenu de ses propriétés globales, ce canal artificiel ouvre les portes de nouvelles recherches fondamentales sur le transport et la signalisation cellulaires, de nouvelles possibilités dans le développement de médicaments, et le potentiel de nouveaux types de biocapteurs.
Un fil conducteur qui maintient l'équilibre délicat d'un système biologique complexe est le canal ionique transmembranaire. Ce sont des supramoléculaires, ou multi-molécule, voies d'échange d'ions et de molécules intégrées dans les membranes cellulaires pour assurer le transport chimique essentiel vers et depuis la cellule et faciliter la signalisation cellulaire.
Dans les années récentes, les biomolécules synthétiques qui imitent les structures et les fonctions des canaux ioniques naturels ont suscité beaucoup d'intérêt parmi les chercheurs en biologie moléculaire en tant que modèles pour étudier les principes fondamentaux de ces canaux et peut-être, même créer des alternatives médicamenteuses ou développer des biocapteurs avancés.
Cependant, bien que plusieurs bons canaux ioniques synthétiques aient été développés, la plupart d'entre eux sont activés via un seul stimulus et aucun n'est ce que les scientifiques appellent « anisotrope à double stimuli, " ou ceux qui peuvent être activés et contrôlés par deux types spécifiques de stimuli dépendant de l'orientation biaisée de la structure à l'intérieur de la membrane. Cela a une portée de recherche limitée dans le domaine.
Maintenant, finalement, un groupe de scientifiques de Tokyo Tech et de l'Université de Tokyo, Japon, ont réussi à synthétiser une biomolécule qui ressemble à un canal anisotrope naturel sensible à deux stimuli :le potentiel de récepteur transitoire mélastatine 8 (TRPM8), qui sous-tend les transmissions de signaux dans les neurones. Leur chaîne s'appelle VF et leur percée est publiée dans Journal de l'American Chemical Society .
La FV est une molécule amphiphile multibloc (elle a à la fois des propriétés d'amour de l'eau (hydrophile) et d'amour de la graisse (lipophile)) qui peut s'assembler pour former des canaux supramoléculaires. Chaque unité d'un bloc comprend une fraction organique lipophile/hydrophobe avec six atomes de fluorure qui la positionnent dans la bicouche lipidique de la membrane cellulaire et lui confèrent une polarité électrique ; un groupe ester phosphate qui assure que la structure est biaisée dans son orientation (avec le côté phosphate vers l'espace extracellulaire); et des chaînes hydrophiles flexibles d'éthylène glycol entre les unités hydrophobes et sur les extrémités qui contribuent à la réactivité aux stimuli.
Les études scientifiques de cette structure ont montré qu'en manipulant les polarités et les amplitudes des tensions appliquées, le canal pourrait être activé. le professeur Kazushi Kinbara, scientifique principal de l'équipe, explique :« Sans application d'une tension, les unités hydrophobes de VF se repoussent de sorte qu'elles seraient spatialement séparées les unes des autres et ne formeraient pas de canaux ioniques transmembranaires clairs et fonctionnels. Lorsqu'une tension avec le vecteur de champ électrique antiparallèle à la polarité électrique du VF est appliquée, un déplacement de la distribution des électrons dans VF se produit, affaiblir la répulsion entre les unités hydrophobes et améliorer leur empilement face à face. Cela provoque des changements de conformation dans toute la molécule, ce qui conduit à la formation de canaux supramoléculaires capables de transporter efficacement les ions à travers la membrane. »
Les scientifiques ont découvert que le deuxième stimulus avait à voir avec la liaison du ligand (R)-propranolol à la connexion entre les esters phosphates et les unités hydrophobes. Comme l'explique le professeur Kinbara, "(R)-propranolol est un agent antiarythmique connu pour bloquer les canaux sodiques voltage-dépendants. De plus, nos études précédentes ont indiqué qu'il interagit avec les groupes ester phosphate et les unités aromatiques pour se localiser à l'intérieur du pore du canal et bloquer le transport des ions. C'est pourquoi nous l'avons choisi pour notre étude." Leur spectroscopie de résonance magnétique nucléaire a révélé sa liaison aux sites phosphates, et qu'il inhibe complètement le flux de courant et donc l'activité des canaux ioniques de la FV. Son élimination via l'ajout de -cyclodextrine réactive le canal. "La liaison réversible de ligand comme celle-ci est essentielle au maintien de l'homéostasie dans le corps via la régulation des canaux ioniques transmembranaires. L'orientation hautement régulée de la FV a permis cette réponse anisotrope à cette molécule de ligand, " déclare le professeur Kinbara. " Avec notre succès dans cette étude, il y a maintenant un grand potentiel pour détecter et manipuler divers événements biologiquement importants."
En effet, avec la synthèse de VF, adapté aux environnements cellulaires variables omniprésents dans les systèmes biologiques, peut-être, de nouvelles possibilités de recherche émergent dans le domaine de la biologie moléculaire.