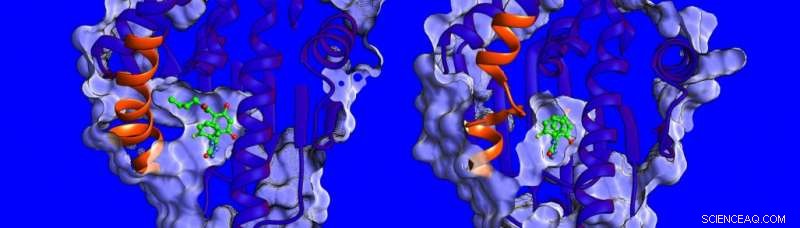
Différences dans la structure et la dynamique de la région hélicoïdale (affichée en orange) de la protéine HSP90. Crédit : Institut d'études théoriques de Heidelberg
Une étude conjointe industrie/université d'une protéine cible du cancer révèle une relation inhabituelle entre la flexibilité du site de liaison et la durée de vie du médicament cible. Les résultats, Publié dans Communication Nature , proposer une nouvelle stratégie pour la découverte de médicaments. La recherche a été réalisée dans le cadre du consortium Kinetics for Drug Discovery K4DD, soutenu par l'Initiative Médicaments Innovants.
La plupart des médicaments exercent leur effet thérapeutique en se liant à une molécule de protéine cible, interférant ainsi avec la fonction normale de la protéine. Traditionnellement, il a été considéré que plus un médicament se lie étroitement à sa protéine cible, c'est-à-dire que plus son affinité de liaison est grande, plus il sera efficace. Cependant, les médicaments doivent fonctionner dans l'environnement en constante évolution des organismes vivants. Il est donc de plus en plus reconnu que non seulement l'affinité de liaison et la thermodynamique, mais aussi les temps de résidence et la cinétique des cibles médicamenteuses doivent être optimisés au cours du processus de découverte de médicaments.
La cinétique à l'épreuve :étudier une cible cancéreuse
Une équipe multidisciplinaire de scientifiques des partenaires de K4DD Merck KGaA (Darmstadt), Institut d'études théoriques de Heidelberg (HITS), et l'Instituto de Biologia Experimental e Tecnológica (iBET) (Lisbonne), appliqué des approches expérimentales et informatiques de pointe pour étudier les déterminants des temps de résidence cibles pour un ensemble d'inhibiteurs d'une cible cancéreuse largement étudiée, protéine de choc thermique 90 (HSP90). Les inhibiteurs de HSP90 peuvent perturber le cycle cellulaire et potentiellement arrêter la croissance tumorale. L'équipe a récemment publié certains de ses résultats dans Communication Nature .
Résultats surprenants :une plus grande mobilité des sites de liaison entraîne des temps de séjour plus longs
"À l'heure actuelle, on sait peu de choses sur les facteurs influençant les temps de résidence des médicaments cibles, nous avons donc décidé de mesurer la thermodynamique et la cinétique de liaison, résoudre les structures des complexes HSP90-inhibiteurs et simuler leur dynamique, " dit le Dr Marta Amaral, l'un des auteurs correspondants. Les structures déterminées par cristallographie aux rayons X montrent que la poche de liaison de HSP90 est bordée par une région qui peut prendre la forme d'une hélice ou d'une boucle lorsqu'elle est liée à différents inhibiteurs (voir image ci-dessous).
Les chercheurs ont découvert que les composés se liant à une hélice présente se lient plus longtemps. "Nous avons été vraiment surpris, " déclare le professeur Rebecca Wade (HITS), « quand nous avons découvert qu'un contributeur important aux longs temps de séjour était la plus grande mobilité de la région hélicoïdale de la poche de liaison lorsque l'inhibiteur s'est lié. » Ce mécanisme de liaison inhabituel ouvre une nouvelle voie pour la conception de médicaments :les scientifiques peuvent envisager des cibles protéiques moins rigides et identifier des molécules qui stabilisent des formes plus mobiles de la protéine lors de la liaison - un peu comme une chaussure de ski avec une doublure intérieure adaptable qui s'ajuste continuellement au pied. Les résultats de cette étude suggèrent une nouvelle façon de trouver des candidats médicaments plus efficaces avec des propriétés cinétiques et thermodynamiques optimales.