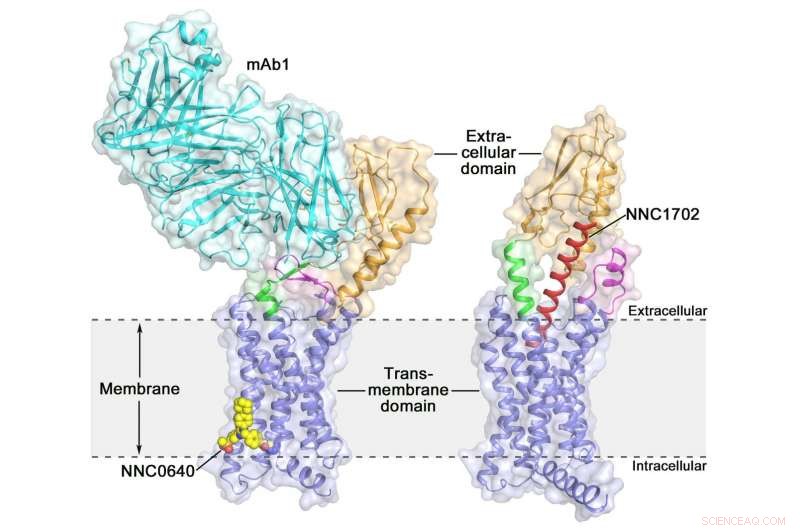
La structure cristalline du récepteur de glucagon humain de pleine longueur (GCGR) structure cristalline du récepteur de glucagon humain de pleine longueur (GCGR) :orange (domaine extracellulaire), bleu (domaine transmembranaire), vert (tige), magenta (la première boucle extracellulaire), rouge (NNC1702), jaune (NNC0640) et cyan (mAb1) Crédit :Dr WU Beili
Les récepteurs couplés aux protéines G de classe B (RCPG) exercent une action essentielle dans l'homéostasie hormonale et sont des cibles thérapeutiques importantes pour diverses maladies, y compris les troubles métaboliques tels que le diabète de type 2. Ces récepteurs sont constitués d'un domaine extracellulaire (ECD) et d'un domaine transmembranaire (TMD), les deux étant nécessaires pour interagir avec leurs ligands peptidiques apparentés et pour réguler la transduction du signal en aval. En raison des difficultés de préparation de protéines de haute qualité, la détermination de la structure des GPCR de classe B pleine longueur reste un défi, limitant ainsi la compréhension des mécanismes moléculaires de l'action des récepteurs.
L'activation du récepteur du glucagon humain (GCGR) par son ligand endogène glucagon déclenche la libération de glucose par le foie pendant le jeûne, ce qui en fait une cible thérapeutique potentielle pour le diabète de type 2. L'année dernière, un groupe de scientifiques du Shanghai Institute of Materia Medica (SIMM) de l'Académie chinoise des sciences a déterminé la structure cristalline du GCGR complet lié à un modulateur allostérique négatif NNC0640 et à un anticorps inhibiteur mAb1, fournissant ainsi pour la première fois une image claire d'un GPCR de classe B pleine longueur à haute résolution.
Récemment, les scientifiques du SIMM ont déterminé la structure cristalline du GCGR en complexe avec un analogue du glucagon et un agoniste partiel NNC1702. Cette structure révèle, pour la première fois, les détails moléculaires d'un GPCR de classe B se liant à son ligand peptidique à haute résolution et révèle de manière inattendue la complexité structurelle qui régit l'activation du récepteur, élargissant ainsi considérablement la compréhension de la transduction du signal GPCR de classe B. L'étude a été publiée dans La nature .
Cette étude offre des informations précieuses sur le mécanisme d'activation de GCGR. La découverte la plus intéressante est que la région de liaison reliant l'ECD et le TMD du récepteur, appelé la « tige, " et la première boucle extracellulaire subissent des changements de conformation significatifs dans leurs structures secondaires dans la structure GCGR liée au peptide par rapport à la structure non liée au peptide précédemment déterminée. Cela conduit à un changement marqué dans l'orientation relative entre l'ECD et le TMD du récepteur pour accueillir la liaison peptidique et initier l'activation du récepteur.
Par ailleurs, la tige peut moduler l'activité du récepteur en facilitant les mouvements conformationnels du récepteur TMD. "Il est étonnant d'observer comment la région de la tige joue un rôle si important dans la régulation de la fonction des récepteurs, bien qu'il ne contienne que 12 acides aminés, " a déclaré le professeur SIMM Dr. ZHAO Qiang. "Cela n'a jamais été observé dans les études structurelles GPCR précédemment résolues. Il approfondit considérablement les connaissances sur les mécanismes de signalisation GPCR de classe B."
Basé sur la structure du complexe GCGR-NNC1702, les chercheurs ont effectué une série d'études fonctionnelles en utilisant des techniques telles que la liaison compétitive de ligands, la signalisation cellulaire, simulations de dynamique moléculaire et spectroscopie de résonance double électron-électron. Les résultats soutiennent la structure du GCGR et confirment les altérations conformationnelles du récepteur dans différents états fonctionnels.
"La structure GCGR nouvellement résolue fournit le modèle le plus précis à ce jour pour la conception de médicaments ciblant le GCGR, qui offre de nouvelles opportunités dans la découverte de médicaments pour le traitement du diabète de type 2, " a déclaré le chef d'équipe et professeur au SIMM, le Dr WU Beili.