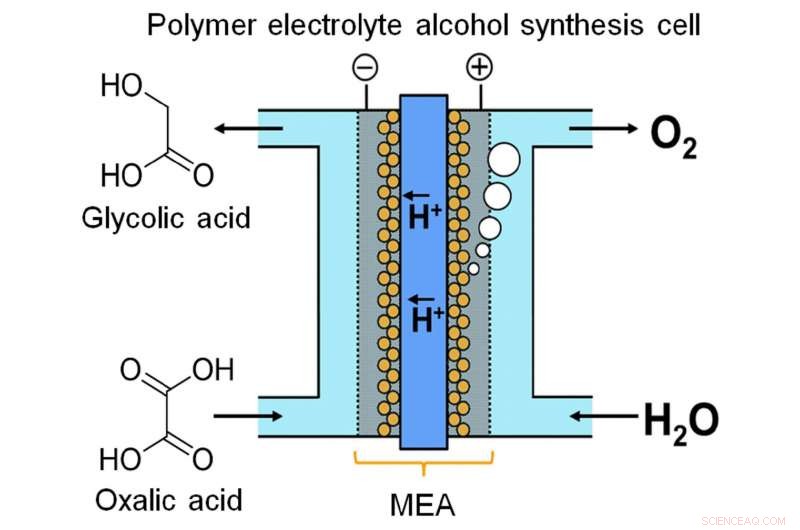
Une équipe de recherche de l'Université de Kyushu a réalisé la synthèse électrochimique continue d'un composé alcoolique à partir d'un acide carboxylique à l'aide d'une cellule d'électrosynthèse d'alcool à électrolyte polymère, qui permet la charge directe de puissance dans le composé alcoolique. Crédit :Masaaki Sadakiyo / Institut international de recherche sur l'énergie neutre en carbone, Université de Kyushu
L'intérêt pour les énergies renouvelables ne cesse de croître. De nombreuses énergies renouvelables, bien que, peut être frustrant par intermittence. Quand le soleil est obscurci par les nuages, ou le vent cesse de souffler, la puissance fluctue. L'approvisionnement fluctuant peut être en partie lissé par le stockage d'énergie pendant les périodes de pointe de production. Cependant, le stockage de l'électricité n'est pas sans défis.
Récemment, une équipe de l'université de Kyushu a créé un dispositif pour stocker de l'énergie sous forme chimique par électrolyse continue. Les chercheurs ont noté que l'acide glycolique (GC) a une capacité énergétique beaucoup plus grande que l'hydrogène, l'un des produits chimiques de stockage d'énergie les plus populaires. La GC peut être produite par réduction à quatre électrons de l'acide oxalique (OX), un acide carboxylique largement disponible. Comme décrit dans leur publication dans Rapports scientifiques , l'équipe a conçu une cellule électrolytique basée sur un nouvel assemblage membrane-électrode. Entre deux électrodes se trouvent une anode à base d'oxyde d'iridium et une cathode en titane (Ti) revêtue de dioxyde de titane (TiO2), reliés par une membrane polymère.
"Les systèmes de type flux sont très importants pour le stockage d'énergie avec réaction en phase liquide, " explique l'auteur principal Masaaki Sadakiyo. " La plupart des électrolyseurs produisant des alcools fonctionnent par lots, qui ne convient pas à cet usage. Dans notre appareil, en utilisant un électrolyte polymère solide en contact direct avec les électrodes, nous pouvons exécuter la réaction comme un flux continu sans ajout d'impuretés (par exemple des électrolytes). La solution OX peut effectivement être considérée comme un pool d'électrons fluide."
Une autre considération clé est la conception de la cathode. La réaction cathodique est catalysée par l'anatase TiO2. Pour assurer une connexion solide entre le catalyseur et la cathode, l'équipe a « fait pousser » du TiO2 directement sur du Ti sous forme de maille ou de feutre. Les images au microscope électronique montrent le TiO2 comme un duvet vaporeux, s'accrochant à l'extérieur des tiges de Ti comme une couche de neige fraîche. En réalité, son travail est de catalyser l'électro-réduction d'OX en GC. Pendant ce temps, à l'anode, l'eau est oxydée en oxygène.
L'équipe a découvert que la réaction s'accélérait à des températures plus élevées. Cependant, augmenter la chaleur trop haut a encouragé un sous-processus indésirable - la conversion de l'eau en hydrogène. L'équilibre idéal entre ces deux effets était à 60°C. A cette température, le dispositif pourrait être encore optimisé en ralentissant le flux de réactifs, tout en augmentant la surface disponible pour la réaction.
De façon intéressante, même la texture du catalyseur de TiO2 flou a fait une différence majeure. Lorsque le TiO2 a été préparé sous forme de « feutre, " en le cultivant sur des tiges Ti plus fines et plus denses, la réaction s'est produite plus rapidement que sur le maillage, probablement à cause de la plus grande surface. Le feutre a également découragé la production d'hydrogène, en recouvrant la surface Ti plus étroitement que le maillage, empêchant l'exposition du Ti nu.
« Dans les bonnes conditions, notre cellule convertit près de 100 pour cent d'OX, ce que nous trouvons très encourageant, ", dit le co-auteur Miho Yamauchi. "Nous calculons que la capacité énergétique volumétrique maximale de la solution GC est environ 50 fois celle de l'hydrogène gazeux. Pour être clair, l'efficacité énergétique, par opposition à la capacité, reste à la traîne par rapport aux autres technologies. Cependant, il s'agit d'une première étape prometteuse vers une nouvelle méthode de stockage de l'excès de courant."