Ce champignon est plein de surprises :le champignon jack-o'-lantern brille dans le noir et produit des peptides qui pourraient être utiles pour l'homme. Crédit :Noah Siegel, wikicommons, CC BY-SA 3.0
Des microbiologistes de l'ETH dirigés par Markus Künzler ont découvert une enzyme remarquable dans un champignon. Ils veulent maintenant l'utiliser pour développer de nouveaux médicaments.
Les champignons semblent offrir un réservoir vraiment inépuisable de nouvelles substances. L'un de ces champignons est le champignon jack-o'-lantern (Omphalotus olearius), qui se trouve dans toute la région méditerranéenne et a un corps de fructification qui brille dans le noir.
Mais ce n'est pas cet effet spécial qui intéresse les chercheurs en médecine; c'est une enzyme récemment découverte par des chercheurs de l'ETH dirigés par le microbiologiste Markus Künzler.
Cette enzyme, OphA, constitue un élément clé d'une voie métabolique qui éloigne les parasites du champignon jack-o'-lantern. « Les champignons se protègent des prédateurs et des compétiteurs grâce à un cocktail de toxines, dont beaucoup sont des protéines ou des peptides, " dit Künzler.
Le champignon jack-o'-lantern utilise l'enzyme OphA pour fournir à l'épine dorsale de l'un de ces peptides des groupes méthyle supplémentaires. Ce n'est que lors de cette altération chimique et de la cyclisation ultérieure que le peptide, omphalotine A, fonctionner comme une toxine. Le champignon l'utilise pour éloigner les parasites tels que les vers ronds.
Une ligne de production difficile à manipuler
Les peptides fongiques servent également de médicaments en médecine. L'une des plus connues est la cyclosporine A, qui a été utilisé dans les greffes d'organes, maladies auto-immunes et médecine du cancer depuis près de 40 ans.
Ce peptide porte des groupes méthyle sur son squelette comme l'omphalotine A. La forme du cycle et les groupes méthyle sont responsables des caractéristiques pharmacologiques avantageuses de la cyclosporine A, en particulier sa disponibilité orale – un facteur qui est actuellement un obstacle important pour les médicaments à base de peptides.
Contrairement à l'omphalotine A, dont l'épine dorsale, comme celle de la majorité des protéines et des peptides d'une cellule, est produit par le ribosome, la cyclosporine A est construite à partir d'acides aminés par une énorme enzyme dédiée à cette tâche. Cette enzyme fonctionne un peu comme une chaîne de production dans l'industrie automobile. "Toutefois, il est difficile de modifier biotechnologiquement cette chaîne de production pour produire des variantes de la cyclosporine A, " dit Künzler.
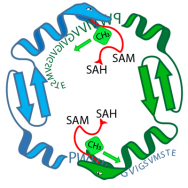
L'enzyme OphA (serpents verts et bleus) équipe un peptide précurseur de l'omphalotine A (séquence de lettres) de groupements méthyle. Au cours de cette phase, l'enzyme et le peptide sont liés. Crédit :Niels van der Velden, Mike Freeman / ETH Zurich
Création de nouveaux peptides en forme d'anneau
En utilisant l'enzyme OphA, cependant, il serait peut-être possible de créer de nouveaux peptides en forme d'anneau plutôt que de simples variantes de l'omphalotine A. Grâce aux groupes méthyle qui leur sont attachés, ces nouveaux peptides posséderaient des caractéristiques pharmacologiques aussi avantageuses que celles de la cyclosporine A.
Cette possibilité est due au fait que les peptides modifiés par OphA sont produits par le ribosome et peuvent donc être facilement altérés via des modifications des gènes codant pour les peptides. En outre, OphA semble être moins sélectif sur les peptides qu'il peut altérer chimiquement. L'enzyme est donc capable d'attacher des groupes méthyle à une large gamme de peptides différents.
« Nous pouvons produire des peptides de départ biotechnologiquement différents et les modifier en utilisant OphA, ce qui peut nous permettre de créer des peptides entièrement nouveaux avec des caractéristiques pharmacologiquement avantageuses, " explique Künzler.
OphA permet ainsi la production de bibliothèques de peptides en forme d'anneau avec des groupes méthyle comme base pour le développement de médicaments peptidiques. Ces bibliothèques de peptides pourraient ensuite être criblées pour les peptides qui présentent une caractéristique biologique souhaitée, comme la capacité de se lier à une protéine cible dans le traitement du cancer.
En raison des groupes méthyle attachés, les peptides ainsi identifiés ont une forte probabilité de manifester des caractéristiques pharmacologiques intéressantes. Cela signifie qu'ils représentent des peptides prometteurs pour le développement de thérapies peptidiques respectives. "Cette approche offre des avantages évidents en termes de rentabilité et de probabilité de succès par rapport aux approches où les groupes méthyle ne sont introduits dans le peptide qu'ensuite, ", explique le microbiologiste.
L'ETH Zurich a déposé une demande de brevet pour l'utilisation d'OphA et d'enzymes apparentées pour insérer des groupes méthyle dans les peptides ribosomiques et pour la procédure utilisée pour créer les bibliothèques de peptides correspondantes. Künzler a reçu une bourse CTI, actuellement sans partenaire industriel, fournir la preuve de principe que la technologie fonctionne. Un spin-off est également en discussion. "Toutefois, nous devons fournir la preuve de concept de la technologie avant de pouvoir commencer à collecter des fonds pour une éventuelle spin-off. » Les deux prochaines années vont probablement faire ou défaire ce plan.
Des experts enthousiastes
Les résultats de Künzler ont été accueillis avec enthousiasme par les experts du domaine. L'intérêt pour son système était élevé lors d'une récente conférence sur les peptides au Canada, et une entreprise a également exprimé son intérêt à acquérir une licence sur le brevet. "C'est amusant d'orienter la recherche fondamentale vers des applications pratiques, " dit Künzler.
Il croit que les champignons ont le potentiel de fournir une large gamme d'agents naturels. Il existe des millions d'espèces différentes de champignons, et le nombre de substances naturelles prometteuses est d'autant plus important. Cependant, il reste réaliste et reconnaît que seule une petite fraction de ceux-ci sera applicable en tant que médicaments. Peut-être que certains de ceux de sa collection de peptides seront parmi eux.