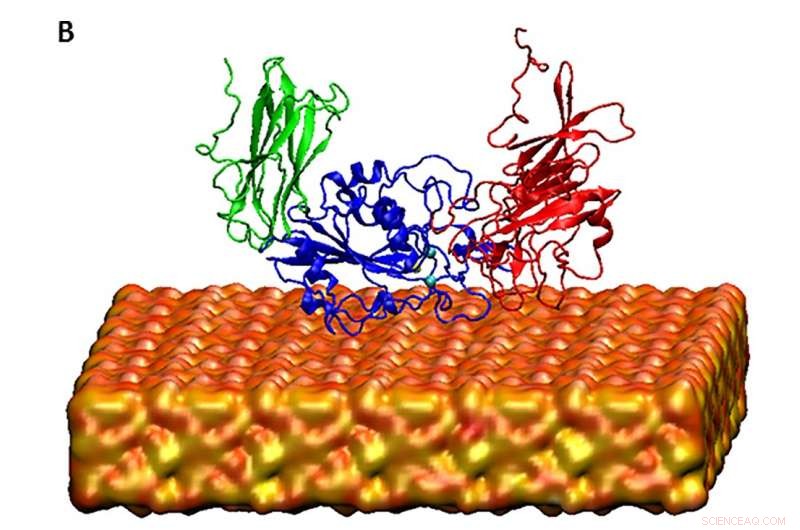
Les supercalculateurs XSEDE Stampede au TACC et Comet au SDSC ont aidé les auteurs de l'étude à simuler le domaine de la pièce de tête de l'intégrine du récepteur de la protéine membranaire cellulaire en solution, basé sur la modélisation de la dynamique moléculaire. Crédit :Davoud Ebrahimi
Certains secrets pour réparer nos squelettes pourraient être trouvés dans les toiles soyeuses des araignées, selon des expériences récentes guidées par des supercalculateurs. Les scientifiques impliqués disent que leurs résultats aideront à comprendre les détails de l'ostéorégénération, ou comment les os se régénèrent.
Une étude a révélé que les gènes pouvaient être activés dans les cellules souches humaines qui initient la biominéralisation, une étape clé dans la formation osseuse. Les scientifiques ont obtenu ces résultats avec de la soie artificielle dérivée de la traîne de toiles d'araignées dorées, qu'ils ont combinés avec de la silice. L'étude est parue en septembre 2017 dans la revue Matériaux fonctionnels avancés et a été le résultat des efforts combinés de trois institutions :Tufts University, Massachusetts Institute of Technology et Nottingham Trent University.
Les auteurs de l'étude ont utilisé les superordinateurs Stampede1 du Texas Advanced Computing Center (TACC) de l'Université du Texas à Austin et Comet du San Diego Supercomputer Center (SDSC) de l'Université de Californie à San Diego grâce à une allocation de XSEDE, l'environnement de découverte scientifique et technique extrême, financé par la National Science Foundation. Les superordinateurs ont aidé les scientifiques à modéliser comment le récepteur de la protéine de la membrane cellulaire appelé intégrine se replie et active les voies intracellulaires qui conduisent à la formation osseuse. La recherche contribuera à des efforts plus importants pour guérir les maladies de la croissance osseuse telles que l'ostéoporose ou la maladie de la valve aortique calcifiée.
« Ce travail démontre un lien direct entre les biomatériaux à base de soie-silice et les voies intracellulaires conduisant à l'ostéogenèse, " a déclaré la co-auteure de l'étude, Zaira Martín-Moldes, chercheur post-doctoral au Kaplan Lab de l'Université Tufts. Elle recherche le développement de nouveaux biomatériaux à base de soie. "Le matériel hybride a favorisé la différenciation des cellules souches mésenchymateuses humaines, les cellules progénitrices de la moelle osseuse, aux ostéoblastes comme indicateur de l'ostéogenèse, ou formation de tissu osseux, ", a déclaré Martín-Moldes.
« La soie s'est avérée être un échafaudage approprié pour la régénération des tissus, grâce à ses excellentes propriétés mécaniques, ", a expliqué Martín-Moldes. C'est biodégradable. C'est biocompatible. Et c'est affinable grâce à des modifications de bio-ingénierie. L'équipe expérimentale de l'Université Tufts a modifié la séquence génétique de la soie d'araignées tisserandes dorées (Nephila clavipes) et a fusionné le peptide promoteur de silice R5 dérivé d'un gène de la diatomée Cylindrotheca fusiformis silaffine.
L'étude sur la formation osseuse a ciblé la biominéralisation, un processus critique en biologie des matériaux. « Nous aimerions générer un modèle qui nous aide à prédire et à moduler ces réponses à la fois en termes de prévention de la minéralisation et de promotion de celle-ci, ", a déclaré Martín-Moldes.
"Des simulations de calcul intensif à haute performance sont utilisées avec des approches expérimentales pour développer un modèle pour l'activation de l'intégrine, qui est la première étape du processus de formation osseuse, " a déclaré le co-auteur de l'étude Davoud Ebrahimi, un associé postdoctoral au Laboratoire de mécanique atomistique et moléculaire du Massachusetts Institute of Technology.
L'intégrine s'intègre dans la membrane cellulaire et transmet les signaux entre l'intérieur et l'extérieur des cellules. Dans son état dormant, l'unité principale qui dépasse de la membrane est penchée comme un dormeur penché. Cet état inactif empêche l'adhésion cellulaire. Dans son état activé, l'unité de tête se redresse et est disponible pour la liaison chimique au niveau de sa région de ligand exposée.
« L'échantillonnage de différents états de la conformation des intégrines en contact avec des surfaces silicifiées ou non pourrait prédire l'activation de la voie, " a expliqué Ebrahimi. L'échantillonnage du repliement des protéines reste un problème classiquement coûteux en calcul, malgré des efforts récents et importants dans le développement de nouveaux algorithmes.
La chimère soie-silice dérivée qu'ils ont étudiée pesait environ 40 kilodaltons. « Dans cette recherche, ce que nous avons fait pour réduire les coûts de calcul, nous n'avons modélisé que le morceau de tête de la protéine, qui entre en contact avec la surface que nous modélisons, " dit Ebrahimi. " Mais encore une fois, c'est un gros système à simuler et ne peut pas être fait sur un système ordinaire ou des ordinateurs ordinaires."
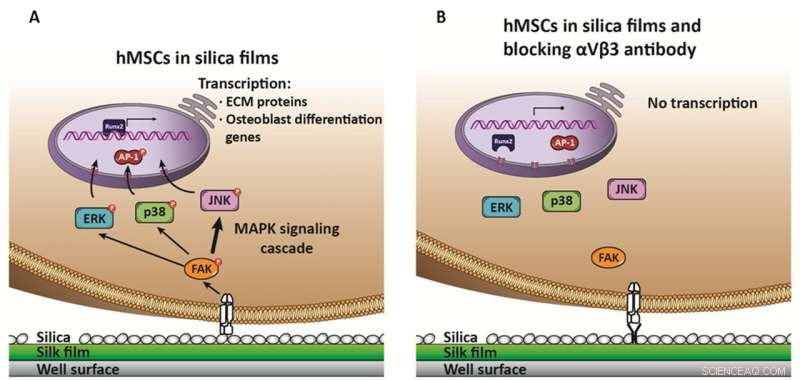
Mécanisme proposé pour l'induction de l'ostéogenèse hMSC sur les surfaces de silice. La fixation de l'intégrine αVβ3 à la surface de la silice favorise son activation, qui déclenche une cascade d'activation impliquant les trois voies MAPK, ERK, p38, mais principalement JNK (reflété par une flèche plus large), qui favorise l'activation et la translocation d'AP-1 vers le noyau pour activer le facteur de transcription Runx2. Runx2 est finalement responsable de l'induction des protéines de la matrice extracellulaire osseuse et d'autres gènes de différenciation des ostéoblastes. B) En présence d'un anticorps neutralisant contre αVβ3, il n'y a pas d'activation et d'induction des cascades MAPK, donc pas d'induction de gènes de la matrice extracellulaire osseuse et donc, aucune différenciation. Crédit :Davoud Ebrahimi
L'équipe de calcul du MIT a utilisé le package de dynamique moléculaire appelé Gromacs, un logiciel de simulation chimique disponible sur les systèmes de calcul intensif Stampede1 et Comet. « Nous pourrions effectuer ces grandes simulations en ayant accès aux clusters de calcul XSEDE, " il a dit.
« J'ai une expérience positive de très longue date avec les ressources XSEDE, " a déclaré Ebrahimi. " Je les utilise depuis près de 10 ans maintenant pour mes projets au cours de mes expériences de diplôme et de post-doctorat. Et le personnel de XSEDE est vraiment utile si vous rencontrez des problèmes. Si vous avez besoin d'un logiciel qui doit être installé et qu'il n'est pas disponible, ils vous aident et vous guident tout au long du processus de recherche. Je me souviens avoir échangé beaucoup d'e-mails la première fois que j'essayais d'utiliser les clusters, et je n'étais pas si familier. J'ai reçu beaucoup d'aide des ressources XSEDE et des personnes de XSEDE. J'apprécie vraiment le temps et les efforts qu'ils mettent pour résoudre les problèmes de calcul que nous rencontrons habituellement lors de notre simulation, " réfléchit Ebrahimi.
Le calcul combiné à l'expérimentation a permis de faire avancer les travaux dans le développement d'un modèle d'ostéorégénération. "Nous proposons un mécanisme dans notre travail, " a expliqué Martín-Moldes, « qui commence par la surface silice-soie activant un récepteur spécifique de la protéine membranaire cellulaire, dans ce cas, l'intégrine αVβ3." Elle a déclaré que cette activation déclenche une cascade dans la cellule par le biais de trois voies de la protéine kinase activée par les mitogènes (MAPK), la principale étant la cascade de la kinase N-terminale c-Jun (JNK).
Elle a ajouté que d'autres facteurs sont également impliqués dans ce processus tels que Runx2, le principal facteur de transcription lié à l'ostéogenèse. Selon l'étude, le système de contrôle n'a montré aucune réponse, et le blocage de l'intégrine à l'aide d'un anticorps non plus, confirmant son implication dans ce processus. "Un autre résultat important a été la corrélation entre la quantité de silice déposée dans le film et le niveau d'induction des gènes que nous avons analysés, " Martín-Moldes a déclaré. "Ces facteurs fournissent également une caractéristique importante à contrôler dans la future conception de matériaux pour les biomatériaux de formation d'os."
"Nous faisons ici une recherche fondamentale avec nos systèmes soie-silice, " Martín-Moldes a expliqué. "Mais nous aidons à construire la voie pour générer des biomatériaux qui pourraient être utilisés à l'avenir. La minéralisation est un processus critique. L'objectif final est de développer ces modèles qui aident à concevoir les biomatériaux pour optimiser le processus de régénération osseuse, lorsque l'os doit se régénérer ou le minimiser lorsque nous devons réduire la formation osseuse."
Ces résultats aident à faire avancer la recherche et sont utiles dans des efforts plus larges pour aider à guérir et à traiter les maladies osseuses. « Nous pourrions aider à guérir les maladies liées à la formation osseuse, comme la calcification de la valve aortique ou l'ostéoporose, dont nous avons besoin de connaître la voie pour contrôler la quantité d'os formé, pour le réduire ou l'augmenter, dit Ebrahimi.