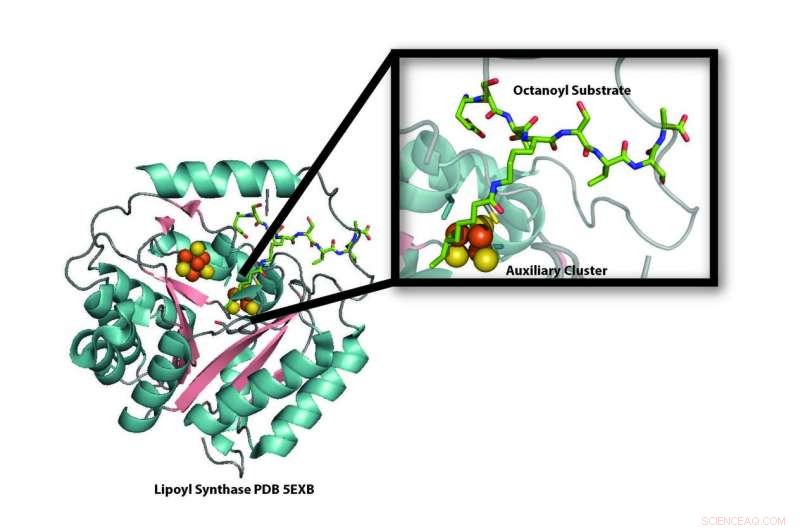
Modèle de la structure cristalline de l'enzyme lipoyl synthase (LipA) de la bactérie Mycobacterium tuberculosis révélant la destruction d'un de ses amas fer-soufre (boules oranges et jaunes) pour l'utiliser comme source de soufre pour la production d'acide lipoïque. De nouvelles recherches démontrent que le cluster fer-soufre qui est détruit lors de la production d'acide lipoïque est remplacé par une protéine porteuse fer-soufre, NfuA, afin que LipA puisse continuer à produire de l'acide lipoïque. Crédit :Laboratoire Booker, Université d'État de Pennsylvanie
De nouvelles recherches montrent comment une protéine est consommée puis reconstituée lors de la production d'acide lipoïque, un composé requis par notre corps pour convertir l'énergie de la nourriture en une forme qui peut être utilisée par nos cellules. L'enzyme lipoyl synthase (LipA) élimine deux atomes d'hydrogène d'une chaîne carbonée inerte et les remplace par des atomes de soufre de l'un de ses propres amas fer-soufre pour créer de l'acide lipoïque, se rendant inactif dans le processus. La nouvelle recherche de la Penn State University, qui sera publié dans la revue Science le 20 octobre, 2017, montre qu'une autre protéine, un transporteur de cluster fer-soufre appelé NfuA, remplace le cluster fer-soufre détruit dans LipA, lui permettant de continuer à produire de l'acide lipoïque. Les résultats pourraient également aider les scientifiques à comprendre pourquoi les humains présentant des défauts dans le gène transporteur fer-soufre - une maladie mortelle - ont des carences en acide lipoïque.
« LipA se cannibalise pour fournir les atomes de soufre nécessaires à la production d'acide lipoïque, " dit l'écuyer Booker, professeur de chimie et de biochimie et biologie moléculaire à la Penn State University, un chercheur du Howard Hughes Medical Institute, et l'auteur correspondant du document de recherche. "Lorsque nous l'avons démontré en 2011, c'était déroutant car si LipA est détruit, comment la cellule pourrait-elle produire suffisamment d'acide lipoïque ? »
LipA fait partie de la famille des enzymes radicalaires SAM (S-adénosylméthionine). Comme la plupart des enzymes SAM radicales, il contient un amas de quatre atomes de fer et quatre atomes de soufre, qu'il utilise pour convertir SAM en un radical de haute énergie. À son tour, ce radical peut éliminer les atomes d'hydrogène d'autres molécules, une étape nécessaire pour activer de nombreuses réactions métaboliques cellulaires importantes. Les atomes d'hydrogène sont remplacés par du soufre pour terminer le processus.
D'où viennent les atomes de soufre que LipA utilise pour produire de l'acide lipoïque et comment ils sont attachés ont été des questions majeures dans le domaine. La façon dont d'autres enzymes attachent les atomes d'oxygène aux centres de carbone inerte est assez bien comprise. Dans ces cas, oxygène, qui est omniprésent dans l'atmosphère, est utilisé pour créer des radicaux de haute énergie et est également la source de l'atome d'oxygène ajouté. Soufre, d'autre part, n'est pas disponible de la même manière, mais contrairement à la plupart des autres enzymes SAM radicales, LipA a un cluster fer-soufre supplémentaire.
"Nous savions par des travaux antérieurs que LipA utilisait son deuxième cluster fer-soufre comme source d'atomes de soufre pour créer de l'acide lipoïque, " a déclaré Erin L. McCarthy, un étudiant diplômé du laboratoire de Booker et le premier auteur de l'article. "Mais cela a créé un problème. Si LipA a volé des atomes de soufre de son propre cluster fer-soufre, l'enzyme serait détruite et ne pourrait donc plus créer d'acide lipoïque. Quand nous avons appris que les humains avec des gènes NFU1 défectueux, l'équivalent humain du gène bactérien NfuA utilisé dans nos expériences, avait des carences en acide lipoïque, nous avons pensé que ce transporteur fer-soufre pourrait remplacer le cluster fer-soufre consommé dans LipA, lui permettant de continuer à fabriquer de l'acide lipoïque."
Pour tester cette hypothèse, les chercheurs ont réalisé deux expériences clés. D'abord, ils ont testé si LipA et NfuA s'associent en évaluant à quelle vitesse les molécules migrent à travers un gel par une technique appelée chromatographie de filtration sur gel. Dans cette technique, les grosses molécules migrent plus vite que les petites molécules. Lorsque LipA et NfuA ont été combinés puis analysés par cette technique, ils ont migré plus rapidement que l'une ou l'autre molécule seule, suggérant que les deux molécules étaient liées ensemble pour former un plus grand, molécule migrant plus rapidement. Les chercheurs ont ensuite créé une version de NfuA qui contenait une forme légèrement différente d'atomes de soufre (34S plutôt que 32S), une forme qu'ils pourraient retracer si elle était incorporée dans LipA puis dans l'acide lipoïque. Dans cette deuxième expérience, les chercheurs ont montré qu'après que le 32S présent à l'origine dans LipA ait été consommé dans la réaction chimique pour produire de l'acide lipoïque, l'acide lipoïque a été produit contenant du 34S, qui ne pouvait provenir que de leur NfuA conçu.
"Nous nous intéressons depuis un certain temps à la fois au processus qui ajoute du soufre à un composé de carbone inerte pour fabriquer de l'acide lipoïque et à la source du soufre ajouté, " a déclaré Booker. " L'acide lipoïque est un élément vital des processus métaboliques de base qui maintiennent nos cellules en vie. Comprendre la réaction qui le crée nous permet non seulement de mieux comprendre ce processus, cela nous donne également un aperçu des maladies humaines comme celle causée par des mutations dans NFU1 qui entraînent une carence en acide lipoïque et la mort. »