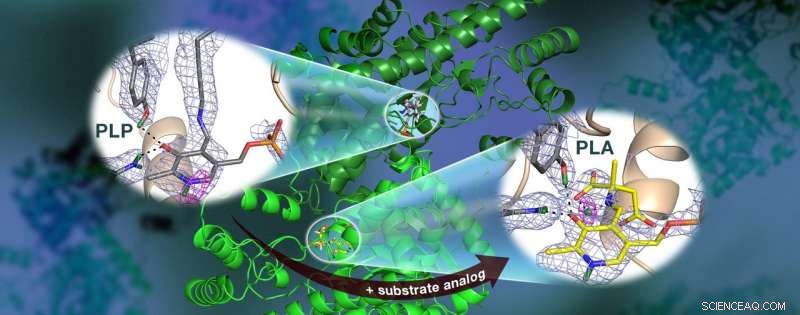
Une équipe dirigée par l'ORNL a utilisé des neutrons pour observer l'enzyme AAT, une protéine dépendante de la vitamine B6, et a constaté que la réaction chimique s'est produite seulement dans un site actif. Les cartes de densité de longueur de diffusion nucléaire (maille colorée) mettent en évidence les positions des atomes d'hydrogène critiques, y compris une liaison hydrogène à faible barrière (maille magenta) qui n'existerait pas dans l'AAT, ce qui peut être crucial pour la catalyse. Crédit :Jill Hemman et Andrey Kovalevsky /Oak Ridge National Laboratory, Département américain de l'énergie
Des scientifiques du laboratoire national d'Oak Ridge du ministère de l'Énergie ont effectué une analyse structurale neutronique d'une protéine dépendante de la vitamine B6, ouvrant potentiellement la voie à de nouveaux antibiotiques et médicaments pour lutter contre des maladies telles que la tuberculose pharmacorésistante, paludisme et diabète.
Spécifiquement, l'équipe a utilisé la cristallographie neutronique pour étudier l'emplacement des atomes d'hydrogène dans l'aspartate aminotransférase, ou AAT, une enzyme vitale pour le métabolisme de certains acides aminés.
"Nous avons visualisé la première structure neutronique d'une enzyme de la vitamine B6 qui appartient à une grande famille de protéines avec des centaines de membres qui existent dans la nature, " a déclaré Andrey Kovalevsky de l'ORNL, un co-auteur principal de l'étude, qui a été publié dans Nature Communications.
Les protéines dépendantes de la vitamine B6 font partie d'un groupe diversifié d'enzymes qui conduisent plus d'une centaine de réactions chimiques différentes dans les cellules. Les enzymes intéressent le biomédical, ainsi que la bioénergie, chercheurs en raison de leur rôle dans le métabolisme des acides aminés et d'autres nutriments cellulaires.
"Ces enzymes sont uniques en ce sens que chacune effectue une réaction chimique spécifique avec une précision exquise, tout en supprimant d'autres transformations chimiques viables, " a déclaré Kovalevsky. " Comment ils accomplissent cela n'est pas bien compris, mais c'est d'une grande importance pour la conception de médicaments."
Les recherches précédentes de l'équipe ont prédit que les atomes d'hydrogène se déplacent dans et autour du site actif de l'enzyme, où a lieu la réaction chimique, indiquant que le positionnement des atomes d'hydrogène contrôle le type de réaction. Connaître l'emplacement précis des atomes d'hydrogène peut expliquer pourquoi le comportement de ces enzymes est si spécifique, mais l'hydrogène est difficile à détecter avec des méthodes standard telles que la cristallographie aux rayons X.
Pour déterminer directement les positions des atomes d'hydrogène au sein de l'AAT, l'équipe dirigée par l'ORNL s'est tournée vers les techniques de diffraction des neutrons. Les chercheurs ont exposé des cristaux de protéines délicats aux neutrons en utilisant la ligne de lumière IMAGINE du réacteur isotopique à haut flux de l'ORNL et la ligne de lumière LADI-III de l'Institut Laue-Langevin à Grenoble, La France.
Étonnamment, l'équipe a observé une réaction au sein d'une biomolécule de protéine AAT alors qu'une autre biomolécule d'AAT était inchangée, fournissant une perspective avant et après de la réaction chimique catalysée par une enzyme.

Steven Dajnowicz de l'ORNL (à gauche) et Andrey Kovalevsky ont préparé un échantillon pour commencer l'analyse structurale neutronique d'une protéine dépendante de la vitamine B6 à l'aide de la ligne de lumière IMAGINE du réacteur à isotope à haut flux de l'ORNL. Les résultats de l'étude pourraient ouvrir la voie à de nouveaux antibiotiques et médicaments pour lutter contre les maladies. Crédit :Genevieve Martin/Laboratoire national d'Oak Ridge, Département américain de l'énergie
"Les données ont révélé que dans l'une des structures biomoléculaires de l'enzyme, les liaisons covalentes se sont réorganisées après qu'une réaction chimique s'est produite dans le site actif et, en autre, la réaction n'avait pas eu lieu, " a déclaré Kovalevsky. " Essentiellement, nous avons pu obtenir deux structures dans un cristal, ce qui n'a jamais été fait auparavant pour aucune protéine utilisant des neutrons."
Avec cette connaissance, l'équipe effectuera des simulations moléculaires pour déterminer le comportement spécifique des atomes d'hydrogène lors de l'interaction avec l'enzyme. Les résultats pourraient être utiles pour guider la conception future de nouveaux médicaments contre la tuberculose multirésistante, paludisme, le diabète et les bactéries résistantes aux antibiotiques.
"Cette étude met en évidence comment les neutrons sont une sonde inégalée pour identifier l'emplacement des atomes d'hydrogène dans les systèmes biologiques, nous fournissant un niveau de détail structurel sans précédent pour cette enzyme importante, ", a déclaré Matthew Blakeley, scientifique de la ligne de lumière LADI-III.