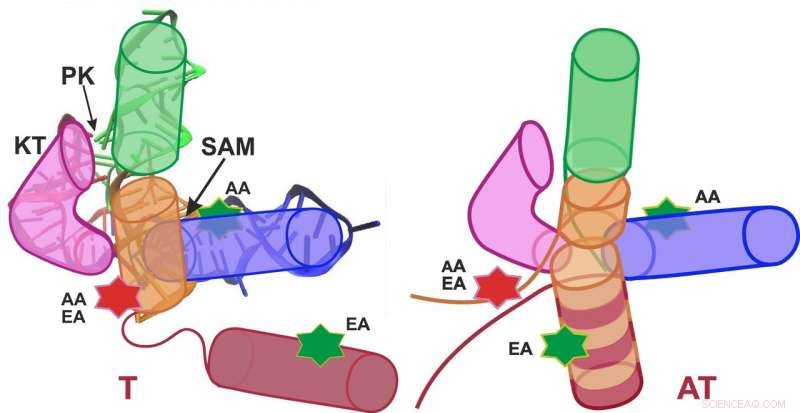
Représentation schématique du riboswitch SAM-I dans la conformation de terminaison (arrêt ; à gauche) et la conformation anti-terminaison (mise en marche ; à droite). Crédit :Graphiques :APH/KIT
De nombreuses bactéries possèdent des éléments de contrôle moléculaire grâce auxquels elles peuvent activer et désactiver des gènes. Ces riboswitchs ouvrent également de nouvelles options dans le développement d'antibiotiques ou la détection et la décomposition de toxines environnementales. Chercheurs de l'Institut de technologie de Karlsruhe (KIT), Université de Heidelberg, et Freie Universität Berlin ont maintenant utilisé la microscopie optique lumineuse de molécules uniques pour étudier fondamentalement le fonctionnement des riboswitches. Ceci est rapporté dans Nature Chimie Biologie .
Les riboswitches sont situés sur l'acide ribonucléique messager (ARNm) qui transporte l'information génétique vers le site de biosynthèse des protéines. Un riboswitch est constitué d'un capteur mesurant la concentration d'une petite molécule métabolique et d'un effecteur contrôlant l'expression génique et, Par conséquent, synthèse d'une protéine. Comme les riboswitches existent dans de nombreux agents pathogènes bactériens, ils représentent des cibles importantes dans le développement de nouveaux antibiotiques. D'autres applications sont possibles en biologie synthétique. Par exemple, les bactéries peuvent être génétiquement modifiées avec des riboswitchs pour détecter et décomposer les toxines environnementales de faible poids moléculaire, tels que les herbicides. Cependant, une compréhension fondamentale des processus sous-jacents à la fonction des riboswitches est requise. Le travail présenté dans Nature Chimie Biologie est une contribution essentielle à cet égard.
Les groupes de recherche du professeur Gerd Ulrich Nienhaus du KIT et du professeur Andres Jäschke de l'université de Heidelberg ont étudié le riboswitch S-adénosyl-L-méthionine (SAM)-I. "L'attachement de la molécule SAM à ce riboswitch provoque la conformation, c'est l'arrangement spatial des atomes, passer de la structure anti-terminaison (AT) à la structure de terminaison (T), " Nienhaus explique. " En conséquence, l'expression des gènes est désactivée."
D'abord, les scientifiques de Heidelberg ont synthétisé des riboswitchs SAM-I et les ont spécifiquement marqués avec deux colorants fluorescents chacun à des points différents. Les chercheurs du KIT ont ensuite étudié ces molécules d'ARN à haute résolution spatiale et temporelle à l'aide de microscopes optiques très sensibles mesurant l'émission fluorescente de molécules monocolores. Au moyen d'expériences de transfert d'énergie de résonance de Förster (FRET), la dynamique de conformation a été déterminée directement. Dans ce but, le rayonnement laser est utilisé pour faire émettre de la lumière à un colorant vert. Si un colorant rouge se trouve à proximité, il peut prendre en charge l'énergie d'excitation du colorant vert et émettre lui-même de la lumière.
La probabilité de transfert d'énergie dépend fortement de la distance des colorants les uns par rapport aux autres. Les changements structurels d'une molécule à laquelle les colorants sont spécifiquement attachés peuvent être observés directement via l'émission du colorant rouge. L'émission lumineuse est extrêmement faible, nécessitant des méthodes d'analyse de données complexes basées sur la modélisation de Markov caché. Le professeur Bettina Keller de l'Institut de chimie et de biochimie de la Freie Universität Berlin a développé les méthodes spécialement pour ce type d'expérience afin de distinguer les signaux d'émission lumineuse dépendant du temps du bruit.
Dans leur analyse, les chercheurs ont distingué deux conformations (T et AT) du riboswitch SAM-I, et un total de quatre conformations (T1, T2, À 1, et AT2). Étonnamment, le riboswitch n'a pas complètement basculé entre les structures T et AT en présence et en l'absence de SAM, comme on s'y attendait, mais fluctuait en permanence entre tous les états — seules les pondérations étaient déplacées. Un résultat important pour la fonction biologique était que les fluctuations de structure observées avec un SAM attaché étaient beaucoup plus rapides que sans SAM. Comme la séquence riboswitch sur l'ARN messager est située directement devant le gène à contrôler, la molécule d'ARN doit former une structure T (switch off) le plus rapidement possible après synthèse en présence de SAM afin d'empêcher la transcription ultérieure du gène à contrôler. L'accélération des fluctuations de structure par l'attachement SAM assure ainsi la formation suffisamment rapide d'une structure en T. "Par conséquent, la dynamique du riboswitch SAM-I joue un rôle important pour sa fonction, " Nienhaus dit. "Ces informations détaillées sur le fonctionnement d'une biomolécule sont le résultat d'une approche interdisciplinaire de la physique, biotechnologie, et la chimie théorique."