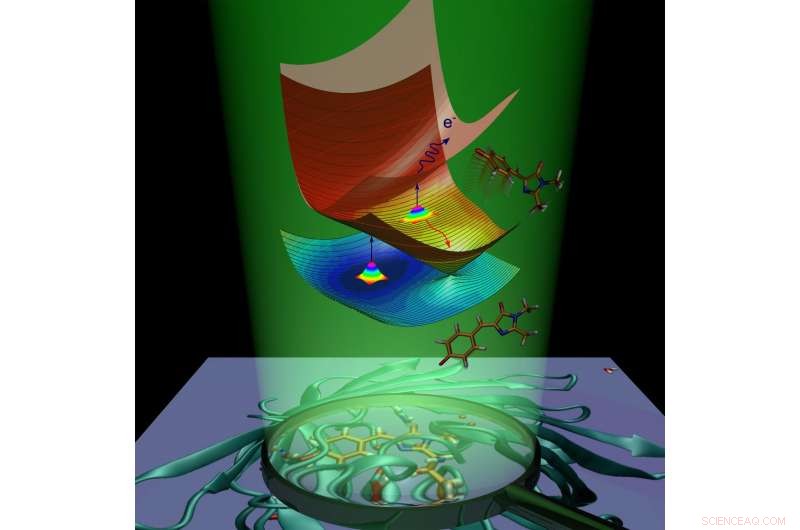
Dynamique moléculaire du chromophore de la protéine fluorescente verte causée par l'absorption de la lumière. Crédit :Anastasia Bochenkova
Des chercheurs de l'Université d'État Lomonossov de Moscou, en coopération avec des physiciens moléculaires danois, ont révélé le mécanisme qui détermine la sensibilité de la protéine fluorescente verte à l'exposition à la lumière. Les scientifiques ont prouvé qu'un groupe chromophore isolé est capable d'émettre de la lumière en dehors de l'environnement protéique, tandis que la fonction de la protéine est d'améliorer ses propriétés fluorescentes. Les résultats sont publiés dans le Journal de l'American Chemical Society .
Les protéines de la famille GFP sont largement utilisées comme biomarqueurs. Avec leur aide, les chercheurs pourraient visualiser les processus biologiques qui se déroulent à l'intérieur des cellules vivantes. Ces protéines sont largement utilisées en biologie moléculaire et cellulaire en raison de leur capacité unique à devenir fluorescentes lors de l'absorption de la lumière d'une certaine longueur d'onde.
Groupes chromophores, ou chromophores, sont responsables de l'absorption de la lumière. Le chromophore est composé de seulement trois résidus d'acides aminés. Jusqu'à maintenant, les chercheurs pensaient que l'environnement protéique provoquait l'émission de lumière par son chromophore sous irradiation. Cette idée a été soutenue par le fait que le chromophore isolé perd ses propriétés fluorescentes lors de la dénaturation des protéines, c'est-à-dire le dépliement de la protéine. Pour la première fois, les auteurs ont prédit et prouvé expérimentalement que le chromophore isolé peut également être fluorescent en dehors de l'environnement protéique, mais seulement à certaines températures.
Après absorption de la lumière, la protéine fluorescente gagne de l'énergie supplémentaire et subit une transition vers l'état excité électroniquement. La molécule de protéine s'efforce de revenir à l'état fondamental en se débarrassant de l'excès d'énergie. Ce processus est appelé désactivation et se déroule de deux manières. Le premier est la fluorescence. En transit de l'état excité à l'état fondamental, le chromophore émet de l'énergie sous forme de lumière, et comme résultat, la protéine devient lumineuse.
La deuxième voie est appelée relaxation non radiative. Au cours de ce processus, énergie d'excitation électronique, transféré à une molécule lors de l'absorption de la lumière, se transforme en énergie vibratoire des noyaux. La conversion interne à l'intérieur de la protéine fluorescente verte est suivie d'une réaction chimique - isomérisation cis-trans du chromophore (c'est-à-dire rotation intramoléculaire autour de l'une des doubles liaisons à l'intérieur de la molécule).
Dans le cas du chromophore anionique (chargé négativement) de la protéine fluorescente verte, l'énergie peut également être transférée à un électron, qui sort du chromophore. Le chromophore, qui subit une isomérisation ou perd un électron, élimine l'excès d'énergie électronique et n'est pas fluorescent. La fluorescence est appelée un canal radiatif de désactivation, tandis que la conversion interne et l'émission d'électrons sont appelées canaux non radiatifs. Les scientifiques ont utilisé expérimentalement les deux canaux non radiatifs pour étudier la désintégration de l'état excité et la récupération de l'état fondamental du chromophore GFP isolé à différentes températures.
Les scientifiques ont montré que le chromophore GFP isolé peut être piégé à l'état excité en raison de la présence de barrières énergétiques intrinsèques le long des voies de désactivation non radiatives. Lorsque le chromophore est refroidi à 100 K, le piégeage dure des nanosecondes, permettant ainsi le canal radiatif lent. Les barrières de piégeage empêchent le chromophore de revenir à l'état fondamental par une conversion non radiative rapide et de provoquer la fluorescence de la molécule.
La chimiste Anastasia Bochenkova de l'Université d'État Lomonossov de Moscou a déclaré :"Le chromophore GFP est intrinsèquement fluorescent. Les interactions entre le groupe chromophore et l'environnement protéique le plus proche améliorent les conditions de piégeage du chromophore à l'état excité, améliorant ainsi la fluorescence moléculaire. Par conséquent, le canal radiatif devient prédominant à l'intérieur de la protéine déjà à température ambiante."
Les scientifiques ont étudié les propriétés du chromophore à la fois théoriquement et expérimentalement. Les scientifiques ont élaboré un modèle théorique et estimé une durée de vie à l'état excité du chromophore isolé, sur la base des calculs de chimie quantique de haut niveau. De tels calculs nécessitent des ressources de calcul performantes, et les scientifiques ont utilisé le Lomonosov Supercomputing Center pour leurs études.
Les scientifiques danois ont conçu et créé une nouvelle technique expérimentale pour étudier la dynamique moléculaire induite par la lumière de chromophores chargés isolés sous vide - spectroscopie d'action pompe-sonde femtoseconde avec une résolution temporelle 2D. Le temps de retard entre deux impulsions laser femtosecondes et le temps de décroissance d'une action moléculaire particulière ont été modifiés. La nouvelle technique résout la dynamique induite par la lumière du chromophore GFP telle qu'elle se produit dans différents canaux de désintégration à travers les états électroniques excités et fondamentaux, en fonction de la température. Sur la base des résultats, les chercheurs ont conclu que les chromophores GFP natifs sont intrinsèquement capables de produire une fluorescence en dehors de l'environnement protéique avec une durée de vie de la nanoseconde, soutenant pleinement les prédictions théoriques.
Anastasia Bochenkova dit, "Notre recherche vise à révéler les mécanismes moléculaires du fonctionnement des systèmes vivants. Un défi fondamental est de comprendre la relation entre les propriétés d'un biosystème photosensible entier et son chromophore actif beaucoup plus petit, qui est au cœur de la machinerie moléculaire. Ici, nous avons montré que les propriétés d'un seul chromophore sont importantes pour comprendre les mécanismes d'action de l'ensemble de la protéine GFP. Cette connaissance est à l'intersection de la physique, chimie et biologie, et conduit à réviser le paradigme dominant sur le rôle de l'environnement protéique dans la fluorescence de la protéine GFP. Au-delà de la résolution de la question sur l'origine de la fluorescence intrinsèque de la GFP, les travaux montrent que les connaissances moléculaires détaillées obtenues grâce à des calculs de chimie quantique de haut niveau peuvent être utilisées avec l'ingénierie moléculaire pour concevoir de nouveaux biomatériaux fonctionnels avec une photoréponse optimale. »