
Le postdoctorant du MIT Sulata Sahu (à gauche) et l'étudiant diplômé Brian Chmielowiec tiennent un échantillon de cuivre presque pur déposé sur une électrode de fer. Crédit :Denis Paiste/Centre de traitement des matières
Les chercheurs du MIT ont identifié la température et le mélange chimique appropriés pour séparer sélectivement le cuivre pur et d'autres oligo-éléments métalliques des minéraux à base de soufre en utilisant l'électrolyse en fusion. Cette étape, processus respectueux de l'environnement simplifie la production de métal et élimine les sous-produits toxiques tels que le dioxyde de soufre.
Le postdoctorant Sulata K. Sahu et le doctorant Brian J. Chmielowiec '12 ont décomposé des minéraux riches en soufre en soufre pur et extrait trois métaux différents à très haute pureté :cuivre, molybdène, et le rhénium. Ils ont également quantifié la quantité d'énergie nécessaire pour exécuter le processus d'extraction.
Une cellule d'électrolyse est un circuit fermé, comme une batterie, mais au lieu de produire de l'énergie électrique, il consomme de l'énergie électrique pour décomposer les composés en leurs éléments, par exemple, fractionnement de l'eau en hydrogène et oxygène. Ces procédés électrolytiques sont la principale méthode de production d'aluminium et sont utilisés comme étape finale pour éliminer les impuretés dans la production de cuivre. Contrairement à l'aluminium, cependant, il n'y a pas de processus de décomposition électrolytique directe pour les minéraux sulfurés contenant du cuivre pour produire du cuivre liquide.
Les chercheurs du MIT ont découvert une méthode prometteuse pour former du cuivre métallique liquide et du gaz sulfureux dans leur cellule à partir d'un électrolyte composé de sulfure de baryum, sulfure de lanthane, et sulfure de cuivre, qui donne plus de 99,9 pour cent de cuivre pur. Cette pureté est équivalente aux meilleures méthodes actuelles de production de cuivre. Leurs résultats sont publiés dans un article d'Electrochimica Acta avec l'auteur principal Antoine Allanore, professeur assistant de métallurgie.
Processus en une étape
"C'est un processus en une seule étape, décomposer directement le sulfure en cuivre et en soufre. Les autres méthodes précédentes sont en plusieurs étapes, " explique Sahu. " En adoptant ce procédé, nous visons à réduire les coûts."
Le cuivre est de plus en plus demandé pour être utilisé dans les véhicules électriques, énergie solaire, l'électronique grand public et d'autres objectifs d'efficacité énergétique. La plupart des procédés d'extraction du cuivre actuels brûlent les minéraux sulfurés dans l'air, qui produit du dioxyde de soufre, un polluant atmosphérique nocif qui doit être capté et retraité, mais la nouvelle méthode produit du soufre élémentaire, qui peut être réutilisé en toute sécurité, par exemple, dans les engrais. Les chercheurs ont également utilisé l'électrolyse pour produire du rhénium et du molybdène, qui se trouvent souvent dans les sulfures de cuivre à de très faibles niveaux.
Le nouveau travail s'appuie sur un article du Journal of The Electrochemical Society de 2016 offrant la preuve de l'extraction électrolytique du cuivre rédigé par Samira Sokhanvaran, Sang-Kwon Lee, Guillaume Lambotte, et Allanore. Ils ont montré que l'ajout de sulfure de baryum à une masse fondue de sulfure de cuivre supprimait suffisamment la conductivité électrique du sulfure de cuivre pour extraire une petite quantité de cuivre pur de la cellule électrochimique à haute température fonctionnant à 1, 105 degrés Celsius (2, 021 degrés Fahrenheit). Sokhanvaran est maintenant chercheur scientifique à Ressources naturelles Canada-Canmet Mining; Lee est chercheur principal à l'Institut coréen de recherche sur l'énergie atomique; et Lambotte est maintenant ingénieur de recherche principal chez Boston Electrometallurgical Corp.
"Cet article a été le premier à montrer que vous pouvez utiliser un mélange où la conductivité électronique domine vraisemblablement la conduction, mais il n'y a pas en fait 100 pour cent. Il y a une infime fraction qui est ionique, ce qui est assez bon pour faire du cuivre, " explique Allanore.
"Le nouvel article montre que nous pouvons aller plus loin que cela et le rendre presque entièrement ionique, c'est-à-dire réduire la part de conductivité électronique et donc augmenter l'efficacité pour fabriquer du métal, " dit Allanore.
Ces minéraux sulfurés sont des composés où le métal et les éléments soufrés partagent des électrons. Dans leur état fondu, il manque un électron aux ions cuivre, en leur donnant une charge positive, tandis que les ions soufre transportent deux électrons supplémentaires, leur donnant une charge négative. La réaction souhaitée dans une cellule d'électrolyse est de former des atomes élémentaires, en ajoutant des électrons à des métaux comme le cuivre, et enlever des électrons du soufre. Cela se produit lorsque des électrons supplémentaires sont introduits dans le système par la tension appliquée. Les ions métalliques réagissent à la cathode, une électrode chargée négativement, où ils gagnent des électrons dans un processus appelé réduction; pendant ce temps, les ions soufre chargés négativement réagissent à l'anode, une électrode chargée positivement, où ils cèdent des électrons dans un processus appelé oxydation.
Dans une cellule qui n'utilisait que du sulfure de cuivre, par exemple, en raison de sa conductivité électronique élevée, les électrons supplémentaires circuleraient simplement à travers l'électrolyte sans interagir avec les ions individuels de cuivre et de soufre aux électrodes et aucune séparation ne se produirait. Les chercheurs du groupe Allanore ont réussi à identifier d'autres composés sulfurés qui, lorsqu'il est ajouté au sulfure de cuivre, modifier le comportement de la masse fondue de sorte que les ions, plutôt que des électrons, deviennent les principaux porteurs de charge à travers le système et permettent ainsi les réactions chimiques souhaitées. Techniquement parlant, les additifs augmentent la bande interdite du sulfure de cuivre de sorte qu'il n'est plus conducteur électroniquement, Chmielowiec explique. La fraction des électrons engagés dans les réactions d'oxydation et de réduction, mesuré en pourcentage du courant total, c'est le flux total d'électrons dans la cellule, s'appelle son efficacité faradique.
Efficacité doublée
Le nouveau travail double l'efficacité pour l'extraction électrolytique du cuivre rapportée dans le premier article, qui était de 28 pour cent avec un électrolyte où seul le sulfure de baryum était ajouté au sulfure de cuivre, à 59 pour cent dans le deuxième papier avec à la fois du sulfure de lanthane et du sulfure de baryum ajoutés au sulfure de cuivre.
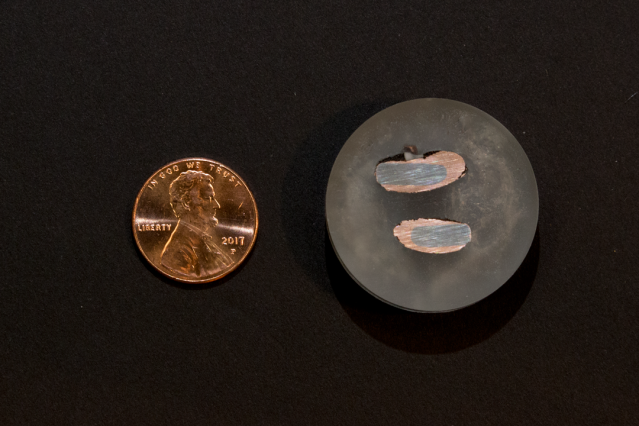
Un nouveau centime, à gauche, contraste avec des échantillons de cuivre presque pur déposés sur une électrode de fer après extraction par un procédé électrochimique. Crédit :Denis Paiste/Centre de traitement des matières
" Démontrer que nous pouvons effectuer des réactions faradiques dans un sulfure de métal liquide est nouveau et peut ouvrir la porte à l'étude de nombreux systèmes différents, " dit Chmielowiec. " Cela fonctionne pour plus que du cuivre. Nous avons pu faire du rhénium, et nous avons pu fabriquer du molybdène." Le rhénium et le molybdène sont des métaux d'importance industrielle qui sont utilisés dans les moteurs d'avions à réaction, par exemple. Le laboratoire d'Allanore a également utilisé l'électrolyse en fusion pour produire du zinc, étain et argent, mais conduire, le nickel et d'autres métaux sont possibles, Il suggère.
La quantité d'énergie requise pour exécuter le processus de séparation dans une cellule d'électrolyse est proportionnelle à l'efficacité faradique et à la tension de la cellule. Pour l'eau, qui fut l'un des premiers composés à être séparé par électrolyse, la tension minimale de la cellule, ou énergie de décomposition, est de 1,23 volt. Sahu et Chmielowiec ont identifié les tensions de cellule dans leur cellule comme 0,06 volts pour le sulfure de rhénium, 0,33 volts pour le sulfure de molybdène, et 0,45 volts pour le sulfure de cuivre. "Pour la plupart de nos réactions, on applique 0,5 ou 0,6 volts, de sorte que les trois sulfures sont ensemble réduits en métalliques, rhénium, molybdène et cuivre, " explique Sahu. A la température de fonctionnement de la cellule et à un potentiel appliqué de 0,5 à 0,6 volt, le système préfère décomposer ces métaux car l'énergie nécessaire pour décomposer à la fois le sulfure de lanthane - environ 1,7 volts - et le sulfure de baryum - environ 1,9 volts - est comparativement beaucoup plus élevée. Des expériences séparées ont également prouvé la capacité de réduire sélectivement le rhénium ou le molybdène sans réduire le cuivre, en fonction de leurs différentes énergies de décomposition.
Potentiel industriel
D'importants métaux stratégiques et de matières premières, y compris, le cuivre, zinc, mener, rhénium, et le molybdène se trouvent généralement dans les minerais sulfurés et moins fréquemment dans les minerais à base d'oxyde, comme c'est le cas pour l'aluminium. "Ce qui est généralement fait, c'est de les brûler dans l'air pour éliminer le soufre, mais en faisant cela, vous faites du SO2 [dioxyde de soufre], et personne n'est autorisé à le diffuser directement dans l'air, ils doivent donc le capturer d'une manière ou d'une autre. Il y a beaucoup de coûts d'investissement associés à la capture du SO2 et à sa conversion en acide sulfurique, " explique Chmielowiec.
Le procédé industriel le plus proche de l'extraction électrolytique du cuivre qu'ils espèrent voir est la production d'aluminium par un procédé électrolytique connu sous le nom de procédé Hall-Héroult, qui produit un bassin d'aluminium métallique en fusion qui peut être exploité en continu. "L'idéal est de faire fonctionner un processus continu, " dit Chmielowiec. " Alors, dans notre cas, vous maintiendriez un niveau constant de cuivre liquide, puis le retireriez périodiquement de la cellule d'électrolyse. Beaucoup d'ingénierie a été consacrée à cela pour l'industrie de l'aluminium, donc nous espérons nous en rajouter. »
Sahu et Chmielowiec ont mené leurs expériences à 1, 227 C, environ 150 degrés Celsius au-dessus du point de fusion du cuivre. C'est la température couramment utilisée dans l'industrie pour l'extraction du cuivre.
Autres améliorations
Les systèmes d'électrolyse en aluminium fonctionnent à 95 % d'efficacité faradique, il y a donc place à l'amélioration par rapport à l'efficacité de 59 pour cent signalée par les chercheurs. Pour améliorer leur efficacité cellulaire, Sahu dit, ils peuvent avoir besoin de modifier la conception de la cellule pour récupérer une plus grande quantité de cuivre liquide. L'électrolyte peut également être réglé davantage, ajouter des sulfures autres que le sulfure de baryum et le sulfure de lanthane. "Il n'y a pas une seule solution qui nous permette de faire ça. Ce sera une optimisation pour le faire passer à plus grande échelle, " dit Chmielowiec. Ce travail continue.
Sahu, 34, a obtenu son doctorat en chimie de l'Université de Madras, en Inde. Chmielowiec, 27, un doctorant de deuxième année et un Salapatas Fellow en science et ingénierie des matériaux, a obtenu son BS en génie chimique au MIT en 2012 et un MS en génie chimique de Caltech en 2014.
Les travaux s'inscrivent dans les travaux du Groupe Allanore sur les matériaux fondus à haute température, y compris les percées récentes dans le développement de nouvelles formules pour prédire la semi-conductivité dans les composés fondus et la démonstration d'une cellule thermoélectrique fondue pour produire de l'électricité à partir de la chaleur résiduelle industrielle. Le Groupe Allanore sollicite un brevet sur certains aspects du procédé d'extraction.
uvre originale et significative
« En utilisant une conception intelligente de la chimie du processus, ces chercheurs ont développé une voie très originale pour produire du cuivre, " dit Rohan Akolkar, le professeur agrégé F. Alex Nason de génie chimique et biomoléculaire à la Case Western Reserve University, qui n'a pas participé à ce travail. « Les chercheurs ont mis au point un processus qui contient de nombreux ingrédients clés :c'est un produit plus propre, évolutif, et un processus en une étape plus simple pour produire du cuivre à partir de minerai sulfuré.
« Technologiquement, les auteurs apprécient la nécessité de rendre le procédé plus efficace tout en préservant la pureté intrinsèque du cuivre produit, " dit Akolkar, qui a visité le laboratoire d'Allanore à la fin de l'année dernière. « Si la technologie est développée davantage et que sa technicité semble favorable, alors il peut fournir une voie potentielle pour une production plus simple et plus propre de cuivre métallique, ce qui est important pour de nombreuses applications. » Akolkar note que « la qualité de ce travail est excellente. Le groupe de recherche Allanore du MIT est à l'avant-garde lorsqu'il s'agit de faire avancer la recherche sur l'électrolyse des sels fondus."
Jacob Jorné, professeur de génie chimique à l'Université de Rochester, déclare :« Les processus d'extraction actuels impliquent plusieurs étapes et nécessitent un investissement en capital élevé, ainsi les améliorations coûteuses sont interdites. L'électrolyse directe des minerais de sulfures métalliques est également avantageuse car elle élimine la formation de dioxyde de soufre, un polluant des pluies acides. "
"L'électrochimie et la thermodynamique dans les sels fondus sont assez différentes de celles des systèmes aqueux [à base d'eau] et les recherches d'Allanore et de son groupe démontrent que beaucoup de bonnes chimies ont été ignorées dans le passé en raison de notre dévouement servile à l'eau, " suggère Jorné. " L'électrolyse directe des minerais métalliques ouvre la voie à une renaissance métallurgique où de nouvelles découvertes et de nouveaux procédés peuvent être mis en œuvre et peuvent moderniser l'industrie d'extraction vieillissante et améliorer son efficacité énergétique. La nouvelle approche peut être appliquée à d'autres métaux de haute importance stratégique tels que les métaux des terres rares. »
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche du MIT, innovation et enseignement.