Crédit :Institut de chimie bioorganique de l'Académie des sciences de Russie
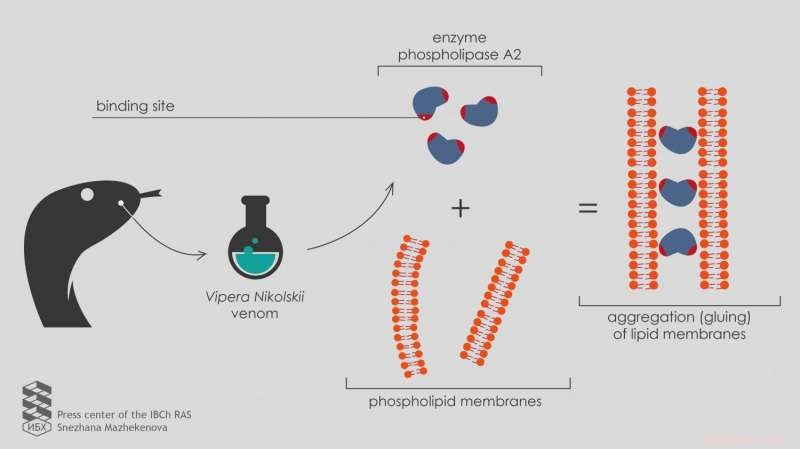
Des scientifiques russes rapportent que l'enzyme phospholipase A2 du venin de Vipera nikolskii est capable d'adhérer aux membranes lipidiques et de provoquer leur agrégation, même si l'activité de l'enzyme est spécifiquement bloquée. Cela est dû à la présence de deux sites de liaison dans la structure enzymatique. Publié dans la revue Toxicon , les résultats aident à comprendre le fonctionnement des venins de serpents à plusieurs composants.
Certains animaux évitent le danger grâce au camouflage, d'autres avec des griffes, dents ou sabots. Et quelques insectes, les araignées, les scorpions et les serpents ont des poisons qui peuvent non seulement paralyser, mais aussi tuer l'attaquant. De nombreux chercheurs s'intéressent aux composants complexes du poison, car ils peuvent être utilisés pour produire des antidotes et créer de nouveaux médicaments. Les venins contiennent des neurotoxines – des poisons qui agissent sur le système nerveux et bloquent la conduction de l'influx nerveux. Ces neurotoxines comprennent certains types d'enzyme phospholipase A2.
L'intérêt des chercheurs pour la phospholipase A2 est dû au fait qu'elle sert de marqueur de l'inflammation. Cela signifie que le niveau de cette enzyme dans le sang augmente avec une inflammation aiguë dans le corps. Par conséquent, plusieurs groupes scientifiques internationaux tentent de créer des systèmes de détection de l'activité de la phospholipase A2.
En 2016, des chercheurs du Laboratoire de chimie des lipides de l'IBCh RAS ont mis au point une méthode de fluorescence fondamentalement nouvelle pour détecter l'interaction de cette enzyme avec une double couche moléculaire de lipides (appelée bicouche lipidique) – la structure de base de la membrane cellulaire. La méthode est basée sur le transfert d'énergie entre deux colorants fluorescents (fluorophores attachés aux molécules de phospholipides) noyés dans la bicouche lipidique.
"Pour tester le nouveau développement sur autant d'échantillons que possible, nous nous sommes tournés vers le Laboratoire de Toxinologie Moléculaire IBCh RAS, " dit Ivan Boldyrev, chercheur senior au Laboratoire de Chimie des Lipides. « Le chef du laboratoire, Youri Outkine, a collecté un ensemble de phospholipases A2 à partir de poisons de divers organismes, comprenant deux phospholipases hétérodimères A2 du venin de Vipera nikolskii. Chacune de ces enzymes est constituée de deux sous-unités hétérofonctionnelles, chaînes polypeptidiques repliées d'une manière spécifique. Cependant, le mécanisme d'effet toxique de ces hétérodimères n'est pas clair."
La recherche a produit des résultats inattendus. Sous l'action de ces "doubles protéines" (hétérodimères), la fluorescence ne s'est pas produite, comme toutes les autres phospholipases, mais à la place pourri.
Une étude plus approfondie en microscopie électronique a montré que les phospholipases hétérodimères A2 du venin de Vipera nikolskii provoquaient l'agrégation des membranes lipidiques, ce qui signifie qu'ils les collent ensemble. Cependant, cet effet n'est apparu qu'avec des membranes chargées négativement.
"Les membranes non chargées sans charge électrique en surface ne se combinent pas sous l'action d'hétérodimères, " explique Anna Alekseeva, chercheur junior au Laboratoire de Chimie des Lipides.
"Nous avons réussi à établir la spécificité des phospholipases hétérodimères A2 pour les membranes chargées négativement et déterminé les conditions de pH du milieu dans lequel l'enzyme se manifeste, " dit Daria Tretiakova, un doctorat étudiant au Laboratoire de Chimie des Lipides.
Les nouvelles données aideront à comprendre l'effet des venins de serpents à plusieurs composants, et la méthodologie développée sera demandée pour étudier d'autres interactions lipides-protéines.