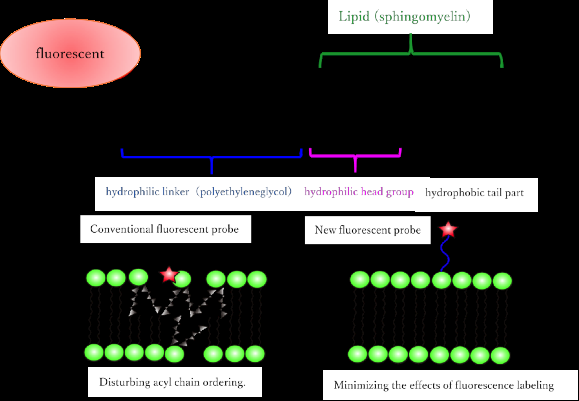
(haut) Molécule d'analogue fluorescente de sphingomyéline nouvellement synthétisée. (En bas) Différences par rapport aux lipides analogiques fluorescents conventionnels. En utilisant une molécule fluorescente hydrophile et un linker, le même comportement que le lipide naturel peut être reproduit. Crédit :Université d'Osaka
Membranes biologiques, comme celles qui entourent les cellules animales, sont constitués de lipides et de protéines. Parce que ces molécules ne se mélangent généralement pas bien, ils sont répartis dans différentes régions de la membrane. Cette ségrégation est réalisée de plusieurs manières, y compris la formation de domaines basés sur des lipides particuliers tels que le cholestérol ou la sphingomyéline (SM). Ces deux lipides sont nécessaires à la génération de domaines de radeau cholestérol-dépendants, qui sont nécessaires à la signalisation au sein de la membrane plasmique. Cependant, il n'était pas clair comment les SM interagissaient avec d'autres molécules de domaines de radeau, principalement en raison de l'absence d'une sonde synthétique appropriée de SM. Maintenant, la recherche menée par l'Université d'Osaka en collaboration avec le projet JST ERATO Lipid Active Structure a développé de nouvelles molécules synthétiques fluorescentes (analogues) qui imitent structurellement les SM et peuvent être étudiées dans des cellules vivantes. L'étude a été rapportée en Journal de biologie cellulaire .
Les analogues de SM fluorescents existants se comportent différemment de leurs homologues naturels pleinement fonctionnels. Par exemple, ils se séparent généralement en un type de phase fluide différent de celui observé dans les membranes vivantes. De plus, ces analogues synthétiques qui se divisent en la phase fluide correcte produisent un faible signal fluorescent, perdent rapidement leur pigment, ou parfois besoin d'être excité par la lumière UV.
Les chercheurs de l'Université d'Osaka ont surmonté ces limitations avec des analogues de SM fluorescents en joignant plusieurs composés chimiques fluorescents (fluorophores) hautement hydrophiles à la partie lipidique hydrophobe (principalement des chaînes acyles) de la molécule synthétique. « Nous avons pris soin de maintenir la charge positive du headgroup en ne modifiant pas sa partie lipidique, ", a déclaré le co-premier auteur Masanao Kinoshita. "Ceci a été réalisé en gardant les composés fluorescents loin du groupe de tête en utilisant un long composant de liaison."
Après avoir confirmé que les molécules synthétiques se comportaient de manière similaire au SM naturel en utilisant des membranes modèles simples, l'équipe a ensuite utilisé l'imagerie à molécule unique hautement sensible pour surveiller le rôle des SM dans les membranes cellulaires vivantes.
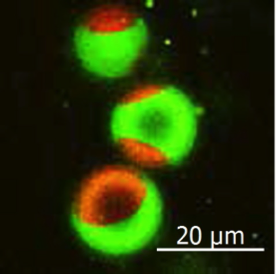
La molécule de sphingomyéline fluorescente verte est localisée dans la région en forme de radeau de la membrane artificielle. La zone rouge est une zone de membrane sans radeau. Crédit :Université d'Osaka
"Nous avons observé des interactions des analogues SM entre eux et avec CD59, qui est un type de récepteur lipidique couramment utilisé pour lier les protéines à la membrane plasmique, ", a déclaré l'auteur correspondant Nobuaki Matsumori. "Il a été démontré que ces interactions nécessitent parfois la présence de cholestérol ainsi qu'une composante alcoolique des SM."
Une analyse plus poussée a révélé le comportement dynamique des SM alors qu'ils s'associaient et se dissociaient rapidement des domaines du radeau impliquant différentes formations de CD59 et avec la membrane plasmique. Ces découvertes peuvent aider à modifier les futures interactions moléculaires telles que l'augmentation de leur taux ou de leur complexité.
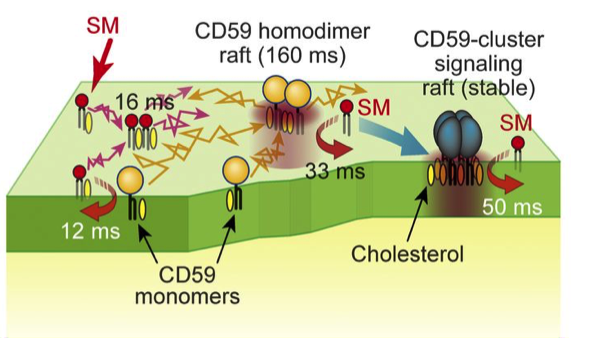
Un diagramme schématique de la liaison transitoire de la sphingomyéline à diverses formes de CD59, ce qui a été précisé dans cette étude. Crédit :(c) 2017 Kinoshita M. et al. Journal de biologie cellulaire . VOL :216 N° :4 1183-1204. doi:10.1083/jcb.201607086