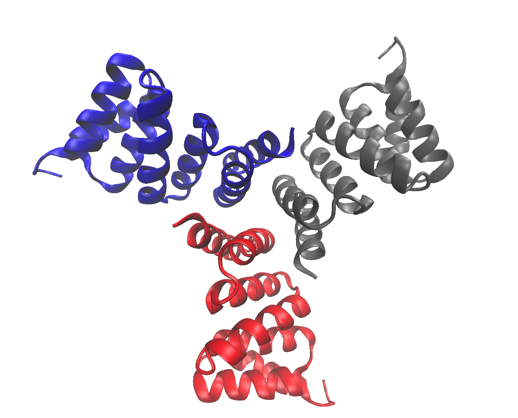
La structure cristalline à haute résolution d'une des protéines étudiées, un trimère conçu par calcul. La structure a été déposée dans la Protein Data Bank sous le numéro d'accès 5HRZ. Crédit :Lawrence Berkeley National Laboratory
Les protéines cycliques qui s'assemblent à partir de plusieurs sous-unités identiques (homo-oligomères) jouent un rôle clé dans de nombreux processus biologiques, y compris la signalisation cellulaire et la catalyse enzymatique et la fonction des protéines. Des chercheurs de la division de biophysique moléculaire et de bioimagerie intégrée (MBIB) du Berkeley Lab ont travaillé avec David Baker de l'Université de Washington, qui a dirigé une équipe pour concevoir in silico et cristalliser des protéines homo-oligomères cycliques auto-assemblantes.
En prédisant et en concevant ces oligomères d'ordre supérieur, Baker et son équipe ont acquis une compréhension des principes fondamentaux qui sous-tendent les interactions oligomère-oligomère. Au-delà des interactions internes de la protéine elle-même, ces oligomères conçus peuvent être utilisés pour explorer des questions fondamentales sur la façon dont la structure des molécules de signalisation affecte le comportement des récepteurs et la réponse cellulaire.
Une stratégie a été développée pour concevoir des interfaces sur des protéines idéalisées visant à diriger leur assemblage en complexes multimères. Les chercheurs du Berkeley Lab ont utilisé la caractérisation structurelle - à la fois la cristallographie des rayons X et la diffusion des rayons X aux petits angles (SAXS) - pour montrer que de nombreuses conceptions adoptaient l'état d'oligomérisation cible et la structure prédite. Non seulement leurs travaux démontrent que les scientifiques ont une compréhension de base de ce qui détermine l'oligomérisation, cela montre également qu'ils peuvent concevoir des protéines avec une forme accordable, Taille, et la symétrie pour une variété d'applications biologiques.
Certains des travaux de cristallographie aux rayons X inclus dans l'article ont été réalisés sous les auspices du programme Crystallography Collective, qui est dirigé par le chercheur scientifique Banumathi Sankaran à Advanced Light Source. Le chercheur Henrique Pereira a cristallisé les protéines conçues par les chercheurs de l'Université de Washington. Sankaran et Peter Zwart, Scientifique du personnel MBIB, collecté des données cristallographiques sur Beamline 5.0.2 au Berkeley Center for Structural Biology et résolu les structures. Pour obtenir des informations sur la dynamique des protéines conçues, Kathryn Burnett et Greg Hura de MBIB ont exécuté SAXS sur la ligne de lumière SIBYLS.
Pereira, Sankaran, et Zwart ont été co-auteurs de plusieurs articles avec Baker et son équipe, qui suivent tous un thème de conception de protéines et de validation de structure.
"Les homo-oligomères cycliques jouent un rôle important dans la fonction biologique, " a déclaré Sankaran. " Ici, nous avons une autre conception synthétique qui s'est avérée correspondre à la conception informatique avec les études de solution aux petits angles et la diffusion des rayons X. "
Ce travail, ainsi que la feuille bêta incurvée et les conceptions de métalloprotéine trimérique, élargir les possibilités de développement de nouvelles thérapies et biomatériaux.