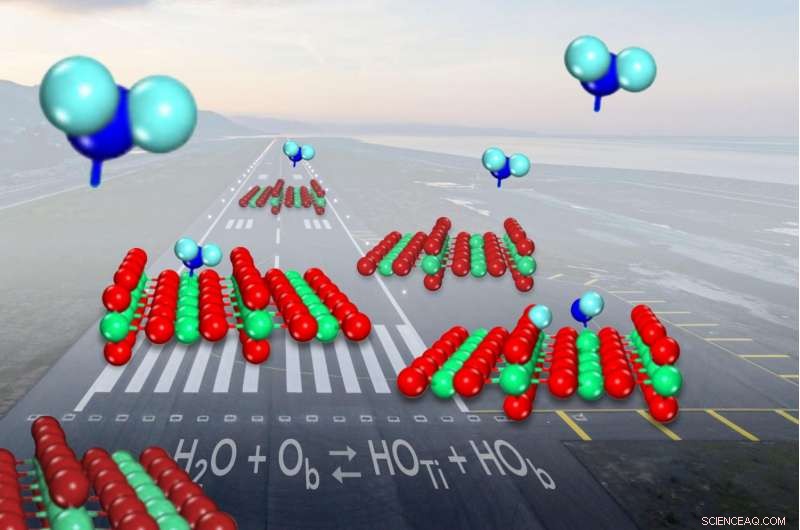
Lorsque l'eau (en bleu) arrive pour atterrir sur l'oxyde de titane du catalyseur commun (en rouge et vert), il se divise en hydroxyles (sur la surface gauche) un peu moins de la moitié du temps. Crédit :Zdenek Dohnalek
Lorsqu'une molécule d'eau arrive pour atterrir sur le catalyseur commun de l'oxyde de titane, il se brise parfois et forme une paire de fragments de molécules appelés hydroxyles. Mais les scientifiques n'avaient pas été en mesure de montrer à quelle fréquence la rupture s'était produite. Maintenant, les chercheurs ont déterminé que l'eau n'est que légèrement plus susceptible de rester en un seul morceau car elle se lie à la surface du catalyseur qu'elle ne l'est pour former les paires d'hydroxyles.
Le résultat - l'avantage de l'eau est si petit - pourrait surprendre certains chimistes. Mais comprendre ce petit avantage a une importance considérable pour une variété d'applications potentielles dans les industries qui utilisent le dioxyde de titane. Ces industries comprennent la production de carburants alternatifs, l'énergie solaire et la sécurité alimentaire, et même des vitres autonettoyantes. Cela aidera également les scientifiques à mieux comprendre le comportement des acides et à approfondir leurs connaissances sur la façon dont les molécules se divisent.
"Comment l'eau se lie était la grande question, " a déclaré le chimiste Zdenek Dohnalek du laboratoire national du Pacifique Nord-Ouest du ministère de l'Énergie. " Les chimistes avaient des informations mitigées provenant de nombreuses méthodes différentes, et les théoriciens avaient aussi des idées. En utilisant une combinaison unique d'instruments, nous l'avons enfin résolu."
L'équipe a rendu compte du travail dans le Actes de l'Académie nationale des sciences .
Terre de mystère
Même si de nombreuses industries utilisent l'oxyde de titane pour accélérer les réactions chimiques, les scientifiques n'ont pas découvert tous ses secrets. Un mystère clé, les chercheurs ont longtemps débattu, est la manière dont l'eau interagit avec l'oxyde de titane. L'interaction est importante en soi pour diviser l'eau, mais elle influence aussi le cours de nombreuses réactions en général.
A la surface de l'oxyde de titane, les molécules d'eau passent de l'état intact à la division en hydroxyles. Même s'il existe de nombreuses façons différentes de mesurer le rapport entre l'eau intacte et les hydroxyles à un moment donné, les scientifiques n'ont pas été en mesure de le déterminer depuis des décennies.
Pour explorer le problème, Les chercheurs du PNNL ont combiné différents outils d'une nouvelle manière. Ils ont envoyé des faisceaux d'eau à différentes vitesses sur de l'oxyde de titane froid placé sous un microscope à très haute résolution connu sous le nom de microscope à effet tunnel.
Le microscope leur a permis de visualiser les atomes de titane et d'oxygène du catalyseur. Les atomes apparaissent sous forme de rangées claires et sombres, comme un champ de maïs avec de hautes rangées de maïs alternant avec des fossés, et les molécules d'eau individuelles apparaissent comme des points lumineux qui ne s'alignent pas avec les rangées.
En plus de voir les molécules d'eau lorsqu'elles frappent la surface, l'équipe a simulé les détails des atomes interagissant dans les moindres détails sur un ordinateur hautes performances. La combinaison d'expériences et de simulations a permis à l'équipe de trancher le débat de longue date.
Attirance instantanée
En forme de V, une molécule d'eau a un gros atome d'oxygène au milieu lié à deux atomes d'hydrogène plus petits de chaque côté. L'oxyde de titane aide à rompre les liaisons entre les atomes pour faire avancer une réaction chimique :les atomes de titane piègent les molécules d'eau, tandis que les oxygènes à proximité, font également partie de la surface du catalyseur, éloigne puis capture l'un des atomes d'hydrogène.
Quand cela arrive, deux hydroxyles sont formés, l'un provenant d'un oxygène de surface se combinant avec l'hydrogène et l'autre des restes de la molécule d'eau.
Les scientifiques avaient besoin de savoir à quelle fréquence les hydroxyles se formaient. Les molécules d'eau restent-elles en grande partie intactes à la surface ? Ou se convertissent-ils immédiatement en hydroxyles ? La probabilité que l'eau reste intacte sur l'oxyde de titane - et la facilité avec laquelle les hydroxyles se reforment en eau - ouvre la voie à d'autres réactions chimiques.
Découvrir, les chimistes ont dû développer des technologies pour mesurer la fréquence à laquelle les hydroxyles sont apparus à la surface. En utilisant les ressources développées au sein de l'EMSL, le Laboratoire des sciences moléculaires de l'environnement, une installation utilisateur du DOE Office of Science au PNNL, ils ont tiré un faisceau de molécules d'eau sur une surface d'oxyde de titane à faible énergie - le faisceau tirant lentement, et à haute énergie, se déplaçant rapidement comme à la sortie d'une lance à incendie.
Ils se sont retrouvés avec des points lumineux à la surface, et plus l'énergie est élevée, plus il y a de taches. Mais les taches ne semblaient pas assez brillantes pour inclure les deux hydroxyles, comme prévu, ils ont donc effectué des expériences supplémentaires pour déterminer quels étaient les points.
Place sur
L'équipe a injecté de l'eau à la surface du dioxyde de titane, puis a gelé l'eau sur place. Puis ils ont tout réchauffé lentement. L'augmentation de la température a révélé les taches - qu'ils pensaient être au moins un hydroxyle - se transformant en molécules d'eau. Cela signifiait que chaque point devait en fait être une paire d'hydroxyles car les preuves montraient que toutes les matières premières nécessaires à la fabrication d'une molécule d'eau se trouvaient là, et les deux hydroxyles étaient nécessaires.
Ils ont effectué diverses autres expériences pour déterminer la température à laquelle une molécule d'eau d'atterrissage se transforme en paires d'hydroxyles et vice versa. De cela, ils ont appris que l'eau n'est que légèrement plus stable que les paires d'hydroxyles à la surface - 10 pour cent de plus, si l'on se fie à la quantité d'énergie qu'il faut pour les perturber.
Simuler les amerrissages sur un calculateur haute performance, également à l'EMSL, les chercheurs ont découvert que les seules molécules d'eau qui se collaient au catalyseur étaient celles qui atterrissaient dans un fossé figuratif dans un champ de maïs, où l'oxygène de l'eau faisait face à un atome de titane dans le fossé.
Si l'eau arrivait à la bonne vitesse, l'eau s'est réorientée et amarrée un de ses hydrogènes vers un oxygène proche, formant les paires hydroxyle vues dans les expériences. Si non, la molécule d'eau vient de rebondir.
"Nous avons découvert que l'électrostatique - la même statique qui fait des étincelles lorsque vous frottez vos pieds sur le tapis - a aidé à diriger les molécules d'eau sur la surface, " a déclaré le chimiste théoricien et coauteur Roger Rousseau.
Tous ces détails aideront les chercheurs à mieux comprendre la catalyse et à améliorer notre compréhension des réactions chimiques. En outre, les résultats révèlent une valeur que les scientifiques tentent depuis longtemps de déterminer :à quel point il est facile ou difficile pour l'eau de perdre de l'hydrogène sur l'oxyde de titane.