En masquant un seul tour d'hélice et en le traitant comme une seule particule, les chercheurs ont pu améliorer considérablement la résolution. Crédit :Source de lumière diamant
Une équipe du Cap a récemment publié le premier article de cryo-microscopie électronique (EM) à haute résolution originaire d'Afrique. Comme décrit dans Nature Communications Biologie , l'équipe a résolu la structure d'une enzyme nitrilases à une résolution proche de l'atome et a utilisé les informations structurelles pour concevoir une enzyme mutante qui pourrait être affinée pour des applications en biotechnologie. Ce travail a été rendu possible grâce à un programme d'accès financé par le projet Synchrotron Techniques for African Research and Technology, une subvention collaborative qui vise à établir des partenariats entre des scientifiques de renommée mondiale en Afrique et au Royaume-Uni travaillant ensemble sur la recherche utilisant la science synchrotron.
Les nitrilases sont une classe fascinante d'enzymes végétales qui jouent un rôle important dans la synthèse d'un large éventail de produits chimiques importants. Ces enzymes ont généralement une spécificité pour une petite gamme de substrats, pourtant, ils ont un énorme potentiel biotechnologique. Une équipe de scientifiques de l'Université du Cap a entrepris de réaliser ce potentiel en étudiant la structure des enzymes à l'aide de cryo-EM au centre de bio-imagerie électronique (eBIC).
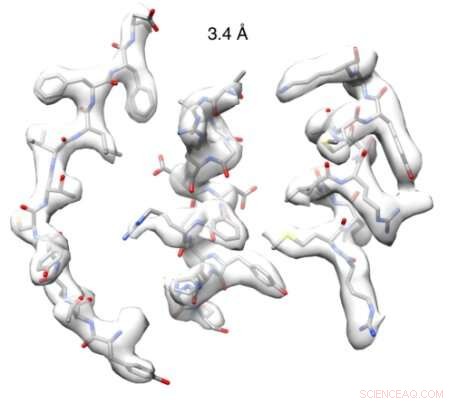
Après avoir réussi à obtenir des informations structurelles de haute qualité, l'équipe a obtenu une image de résolution proche de l'atome (3,4 Å) d'une nitrilase dérivée de la famille du chou. En utilisant cette structure, l'équipe a conçu de manière semi-rationnelle une nouvelle nitrilase mutante qui agissait sur des substrats non catalysés par d'autres nitrilases naturelles.
L'équipe espère pouvoir progresser vers la fabrication de nitrilases « de conception » pour tout substrat requis par l'industrie, qu'il s'agisse de produits pharmaceutiques, produits chimiques fins ou même alimentaires. D'autres travaux à l'eBIC sont prévus pour poursuivre cette étude fructueuse.
Torsades hélicoïdales
Les nitrilases sont une classe d'enzymes qui sont utilisées pour produire des acides carboxyliques, l'ammoniac et les amides pour la synthèse à grande échelle de médicaments et de produits chimiques d'importance industrielle. Une équipe de scientifiques de l'Université du Cap était fascinée par ces enzymes et souhaitait étudier comment elles évoluaient et corréler leur structure et leur fonction.
Le groupe a d'abord comparé deux nitrilases différentes de Arabidopsis thaliana (un membre de la famille des choux) et j'ai vu que l'on avait une large gamme de substrats, mais l'autre était beaucoup plus spécifique à un petit nombre de substrats. Ils ont effectué une série de mutations dans la poche de liaison des enzymes et ont découvert que la commutation d'un seul acide aminé modifiait la préférence de substrat des nitrilases. Avec cette connaissance alléchante, le groupe a décidé d'obtenir des informations structurelles détaillées pour révéler comment les nitrilases choisissent leurs substrats.
Dr Jeremy Woodward, Conférencier en biochimie médicale à l'Université du Cap et chercheur principal de l'étude a expliqué les motivations de son groupe,
"Pour essayer de comprendre ce qui se passait, nous avons imagé toutes les enzymes à l'aide de cryo-EM à basse résolution à l'Université du Cap et avons découvert qu'elles formaient des filaments, et que l'étanchéité de leur torsion hélicoïdale était corrélée à la taille du substrat. En réalité, l'acide aminé que nous avons découvert était situé à une interface entre deux sous-unités hélicoïdales. Nous avons observé cette corrélation avec un grand nombre d'enzymes nitrilase, mais je ne pouvais pas expliquer ce qui se passait au niveau moléculaire jusqu'à notre récente visite à eBIC à Diamond Light Source."
Structure proche de l'atome
L'équipe avait auparavant utilisé la microscopie électronique à coloration négative (EM) qui est limitée à une résolution de 20 Å, et n'est pas assez haut pour voir les détails atomiques dans la structure. En outre, des travaux antérieurs d'autres laboratoires avaient montré que les nitrilases ne peuvent pas être cristallisées, donc cryo-EM était leur seule option.
"C'était la seule méthode qui pouvait être utilisée pour répondre aux questions qu'ils se posaient, " a expliqué le Dr Adriana Klyszejko, associé de recherche post-doctoral à l'eBIC qui a participé à l'étude. « Au Diamant, ce que nous avons créé est un effort intégré à notre communauté d'utilisateurs où ils peuvent pousser leurs recherches plus loin."
A l'eBIC, l'équipe a obtenu une structure à une résolution de 3,4 Å. Dr Woodward, élaboré :
"La haute qualité des données que nous avons obtenues nous a permis de visualiser pour la première fois la structure d'un filament hélicoïdal de nitrilase intact à une résolution proche de l'atome. Nous avons observé une boucle, maintenu en place par l'acide aminé que nous avons découvert, qui limite la taille maximale des substrats liés et se déplace avec une torsion hélicoïdale."
La bourse START
Le travail a été rendu possible grâce à une subvention Synchrotron Techniques for African Research and Technology (START); une initiative mise en place en mars 2019 pour établir des partenariats entre des scientifiques d'Afrique et du Royaume-Uni. START est financé par une subvention de 3,7 millions de livres sterling du Science and Technology Facilities Council (STFC) de l'UKRI du Global Challenges Research Fund (GCRF). Le STFC a obtenu le financement du GCRF, un fonds de 1,5 milliard de livres sterling sur 5 ans qui est un élément clé de la mise en œuvre de la stratégie d'aide britannique, veiller à ce que la recherche britannique joue un rôle de premier plan dans la résolution des problèmes rencontrés par les pays en développement par le biais de la recherche et de l'innovation.
La motivation de START vient des défis sociétaux auxquels sont confrontées les communautés africaines; par exemple, 600 millions de personnes (70%) en Afrique subsaharienne vivent sans électricité, et un approvisionnement fiable en électricité est l'un des outils les plus puissants pour sortir les gens de la pauvreté et mettre fin à leur dépendance à l'égard de l'aide. Les chercheurs de START étudieront les matériaux énergétiques, y compris les structures de cellules solaires, catalyseurs et batteries. Le développement des soins de santé en Afrique est entravé par un manque de compréhension fondamentale de la cause de maladies telles que le paludisme ou le VIH. La biologie structurale donne un aperçu sans précédent des mécanismes derrière ces maladies.
En plus de fournir un accès aux installations de classe mondiale de l'eBIC aux scientifiques d'Afrique du Sud, la bourse a également soutenu un chercheur post-doctoral, Dr Andani Mulelu qui était le chercheur principal de l'étude. "Ce travail n'aurait pas été possible sans cela, parce que l'équipement, le soutien et l'infrastructure nécessaires pour mener à bien cette expérience ne sont pas disponibles en Afrique, " a expliqué le Dr Woodward.
Dr Gwyndaf Evans, Scientifique principal de la ligne de lumière VMXm de Diamond, et Life Sciences Principal Investigator pour les commentaires du projet START :
« L'initiative START vise, entre autres, pour aider à renforcer l'expertise et les capacités pour la biologie structurelle en Afrique. Initialement, nous mettons l'accent sur la facilitation de l'accès aux installations de biologie structurelle de Diamond par le biais de cours de formation ciblés en Afrique du Sud et localement ici chez Diamond. L'objectif ultime est de démontrer aux organismes de financement africains le pouvoir et les avantages de la biologie structurelle pour résoudre les problèmes africains de santé humaine et d'agriculture afin de faire de la biologie structurelle une activité durable sur le continent. Voir des experts comme Jeremy Woodward obtenir un poste permanent en Afrique du Sud est de bon augure pour l'avenir et contribue dans une certaine mesure à renforcer cette durabilité. »
Nitrilases de conception
En utilisant les connaissances acquises grâce à la structure cryo-EM haute résolution, l'équipe a projeté plus de 5, 000 mutants pour concevoir une nouvelle enzyme avec une torsion hélicoïdale modifiée qui agit sur un nouvel ensemble de substrats non catalysés par d'autres nitrilases végétales. Cela a été réalisé en identifiant les acides aminés « hotspot » pour une évolution dirigée et en les sélectionnant en couplant la survie des bactéries à la conversion réussie d'une bibliothèque de substrats.
Fort de ce travail, l'équipe espère affiner les nitrilases pour réaliser leur plein potentiel biotechnologique. « Nous aimerions arriver au point où nous pouvons produire des nitrilases « conceptrices » pour n'importe quel substrat en apportant les modifications appropriées à la torsion hélicoïdale ainsi qu'à la poche de reliure. Pour y parvenir, nous aimerions visualiser une collection de nitrilases clés avec une gamme d'états hélicoïdaux différents (et spécificités de substrat) par cryo-EM haute résolution, " a conclu le professeur Woodward.