Le début de la vie sur Terre et son évolution sur des milliards d’années continuent d’intriguer les chercheurs du monde entier. Le dogme central ou le flux directionnel de l'information génétique depuis un modèle d'acide nucléique désoxyribose (ADN) vers un transcrit d'acide nucléique ribose (ARN), et enfin vers une protéine fonctionnelle, est fondamental pour la structure et les fonctions cellulaires.
L'ADN fonctionne comme le modèle de la cellule et transporte les informations génétiques nécessaires à la synthèse des protéines fonctionnelles. À l’inverse, les protéines sont nécessaires à la synthèse de l’ADN. Par conséquent, la question de savoir si l'ADN ou la protéine a émergé en premier reste un sujet de débat.
Cette version moléculaire de la question « de la poule et de l’œuf » a conduit à la proposition d’un « monde à ARN ». Les ARN sous forme de « ribozymes », ou enzymes ARN, portent des informations génétiques similaires à l'ADN et possèdent également des fonctions catalytiques comme les protéines.
La découverte des ribozymes a encore alimenté l'hypothèse du monde de l'ARN selon laquelle l'ARN remplissait une double fonction de « stockage de l'information génétique » et de « catalyse », facilitant les activités de la vie primitive uniquement par l'ARN. Alors que les ribosomes modernes sont un complexe d'ARN et de protéines, les ribozymes au cours des premiers stades de l'évolution peuvent avoir été reconstitués grâce à l'assemblage d'unités d'ARN fonctionnelles individuelles.
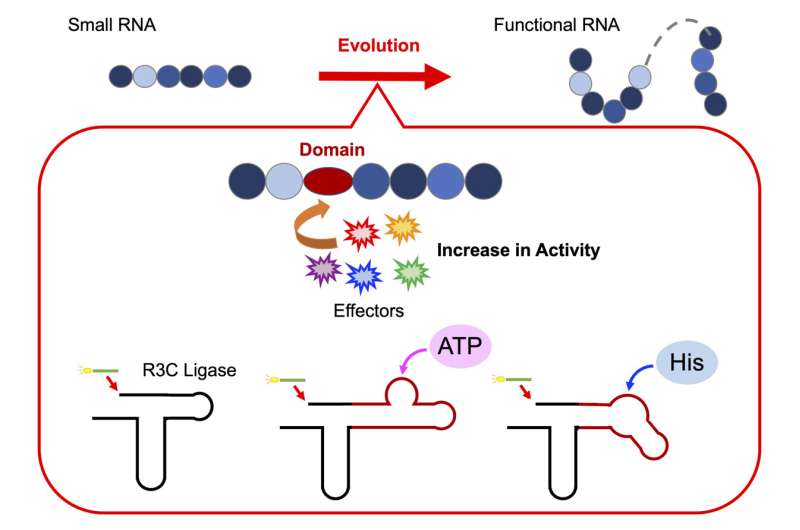
Pour tester cette hypothèse, le professeur Koji Tamura et son équipe de chercheurs du Département des sciences et technologies biologiques de l’Université des sciences de Tokyo ont mené une série d’expériences pour décoder l’assemblage des ribozymes fonctionnels. Pour cela, ils ont conçu un ribozyme artificiel, la R3C ligase, pour étudier comment les unités d'ARN individuelles se réunissent pour former une structure fonctionnelle.
Leurs travaux sont publiés dans la revue Life .
Donnant un aperçu plus approfondi de leurs recherches, le professeur Tamura déclare :« La ligase R3C est un ribozyme qui catalyse la formation d'une liaison 3',5'-phosphodiester entre deux molécules d'ARN. Nous avons modifié la structure en ajoutant des domaines spécifiques qui peuvent interagir avec divers effecteurs."
Au sein des ribosomes, qui sont le site de synthèse des protéines, les unités d'ARN s'assemblent pour fonctionner comme des centres de peptidyl transférase (PTC) de manière à former un échafaudage pour le recrutement d'acides aminés (composants individuels d'un peptide/protéine) attachés aux ARNt. .
Il s'agit d'un aperçu important de l'histoire évolutive des systèmes de synthèse des protéines, mais il ne suffit pas à retracer la voie évolutive basée sur l'hypothèse du monde de l'ARN.
Pour déterminer si l’élongation de l’ARN, obtenue en liant des unités d’ARN individuelles, est régulée de manière allostérique, les chercheurs ont modifié la structure de la ligase R3C. Pour ce faire, ils ont incorporé de courtes séquences d’ARN qui lient l’adénosine triphosphate (ATP), une molécule porteuse d’énergie vitale dans les cellules, dans le ribozyme. L'équipe a noté que l'activité de la R3C ligase dépendait de la concentration d'ATP, une activité plus élevée étant observée à des concentrations d'ATP plus élevées.
De plus, une augmentation de la température de fusion (Tm valeur) a indiqué que la liaison de l'ATP à la ligase R3C stabilisait la structure, ce qui influençait probablement son activité ligase.
De même, en fusionnant une séquence d’ARN liant la L-histidine au ribozyme, ils ont noté une augmentation de l’activité de la ligase à des concentrations croissantes d’histidine (un acide aminé clé). Notamment, l’augmentation de l’activité était spécifique à l’augmentation des concentrations d’ATP ou d’histidine ; aucun changement n'a été observé en réponse à d'autres nucléotides triphosphates ou acides aminés.
Ces résultats suggèrent que l'ATP et l'histidine agissent comme des molécules effectrices qui déclenchent des changements conformationnels structurels dans le ribozyme, qui influencent davantage la stabilité et l'activité de l'enzyme.
L'ATP est le vecteur énergétique central de la cellule qui soutient de nombreux processus moléculaires, tandis que l'histidine est l'acide aminé le plus couramment trouvé dans le site actif des enzymes et maintient leur chimie acido-basique. Compte tenu du rôle important de l'ATP et de l'histidine dans les interactions de l'ARN et les fonctions moléculaires, ces résultats fournissent de nouvelles informations sur le rôle de l'ARN au début de l'évolution, y compris sur l'origine du code génétique.
En outre, les ribozymes modifiés tels que celui développé dans cette étude sont très prometteurs dans une myriade d'applications, notamment l'administration ciblée de médicaments, les thérapies, les nano-biocapteurs, l'ingénierie enzymatique et la synthèse de nouvelles enzymes utilisées dans divers processus industriels.
Dans l’ensemble, cette étude peut offrir un aperçu de la façon dont la transition du monde de l’ARN au « monde ADN/protéine » moderne s’est produite. Une compréhension fondamentale du monde de l'ARN peut à son tour améliorer leur utilisation dans des applications réelles.
"Cette étude mènera à l'élucidation du processus d'"acquisition de la fonction et de la coopérativité basée sur l'allostéricité" dans l'évolution de l'ARN. Les interactions ARN-ARN, les interactions ARN-acides aminés et l'allostéricité appliquées dans cette recherche peuvent guider la fabrication de molécules arbitraires. Les nanostructures d'ARN, avec diverses applications", conclut le professeur Tamura.
Plus d'informations : Yuna Akatsu et al, Développement de ribozymes allostériques pour l'ATP et la l-histidine basés sur le ribozyme ligase R3C, Life (2024). DOI :10.3390/vie14040520
Fourni par l'Université des sciences de Tokyo