Les chercheurs de Yale ont découvert de nouveaux détails sur la façon dont des bactéries comme E. coli construisent leurs barrières protectrices, ce qui éclairera le développement de nouveaux antibiotiques.
Les bactéries résistantes aux antibiotiques constituent un problème croissant dans la lutte contre les infections. Les bactéries qui ont une couche protectrice supplémentaire sur leurs parois cellulaires (un type connu sous le nom de « Gram négatif » en référence à la méthode de coloration utilisée pour l'identifier) sont particulièrement difficiles à combattre.
Les chercheurs de Yale ont progressé dans la compréhension de la façon dont les bactéries génèrent cette couche protectrice grâce à une nouvelle étude qui révèle des nuances supplémentaires et des cibles supplémentaires pour le développement de nouveaux antibiotiques.
Leurs conclusions ont été publiées le 18 avril dans la revue Proceedings of the National Academy of Sciences. .
Un composant essentiel de cette couche protectrice est une molécule appelée lipopolysaccharide (LPS). Les bactéries ont besoin d’une certaine quantité de LPS; trop ou pas assez tue la cellule. Des recherches antérieures du laboratoire de Wei Mi, professeur adjoint de pharmacologie à la Yale School of Medicine, ont révélé comment les capteurs moléculaires d'E. coli trouvent le bon équilibre dans la production de LPS.
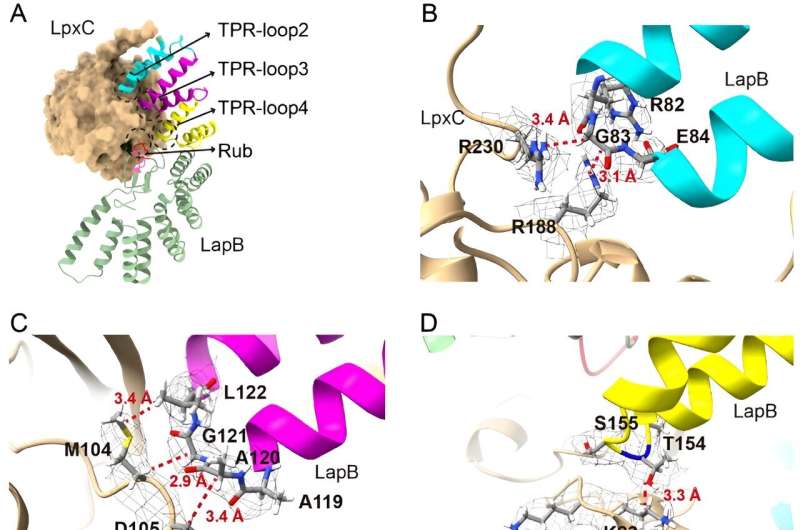
Dans la nouvelle étude, les chercheurs ont approfondi la partie de ce processus qui empêche l’accumulation excessive de LPS, dans le but de clarifier comment une protéine appelée LapB se lie et stimule la dégradation de LpxC, une enzyme qui déclenche la production de LPS. Les chercheurs ont utilisé la microscopie électronique cryogénique pour visualiser la structure du complexe créé lorsque ces deux molécules se lient.
"L'examen de la structure fournit la visualisation la plus directe de la manière dont cette partie du processus se déroule", a déclaré Mi, auteur principal de la nouvelle étude. "Une fois que nous avons vu la structure, nous avons apporté des modifications aux molécules pour voir comment cela affectait la liaison, ce qui nous a permis d'identifier les composants nécessaires pour que LapB reconnaisse LpxC."
Mais les chercheurs ont également découvert, à leur grande surprise, que LapB jouait un deuxième rôle. Non seulement il est responsable de la dégradation de LpxC, mais il inhibe également l'action de l'enzyme avant que la dégradation ne se produise.
"Fondamentalement, LapB arrête LpxC avant de le détruire", a déclaré Mi. "Nous ne comprenons pas pourquoi les bactéries font cela, car cela semble redondant, mais c'est ce que nous étudions actuellement."
Les chercheurs pensent que ce double rôle pourrait être lié à la flexibilité. La dégradation est un processus lent mais irréversible, alors que l'inhibition est rapide et réversible. Disposer de ces deux capacités pourrait permettre aux bactéries de réagir plus rapidement aux changements environnementaux.
"Tout cela est pertinent pour le développement d'antibiotiques", a déclaré Mi. "Ces détails nous aideront à trouver de nouvelles approches et à comprendre pourquoi d'autres ne fonctionnent pas."
Plus d'informations : Sheng Shu et al, Double fonction de LapB (YciM) dans la régulation de la synthèse des lipopolysaccharides d'Escherichia coli, Actes de l'Académie nationale des sciences (2024). DOI : 10.1073/pnas.2321510121
Informations sur le journal : Actes de l'Académie nationale des sciences
Fourni par l'Université de Yale