Certaines protéines changent de forme lorsqu'elles sont exposées à différentes températures, révélant des sites de liaison jusqu'alors inconnus pour les médicaments, selon de nouvelles recherches.
Les résultats, publiés dans Nature , pourrait révolutionner de larges pans de la biologie en modifiant fondamentalement la façon dont la structure des protéines est étudiée et exploitée pour la conception de médicaments. L'étude a été dirigée par Juan Du, Ph.D. et Wei Lü, Ph.D. de l'Institut Van Andel.
Les protéines sont généralement étudiées à basse température pour garantir leur stabilité. Cependant, la nouvelle étude démontre que certaines protéines sont très sensibles à la température et changent de forme lorsqu'elles sont observées à la température corporelle.
"Pendant longtemps, les méthodes que nous avons utilisées pour étudier les protéines nécessitent qu'elles soient froides ou congelées. Mais dans le monde réel, les protéines humaines existent et fonctionnent à la température du corps", a expliqué Du. "Notre étude décrit une nouvelle façon d'étudier les protéines à la température corporelle et révèle que certaines protéines modifient radicalement leurs structures lorsqu'elles sont chaudes, ouvrant ainsi de nouvelles opportunités pour le développement de médicaments guidés par leur structure."
Les protéines sont les bêtes de somme moléculaires du corps. Leur forme détermine la façon dont ils interagissent avec d’autres molécules pour accomplir leur travail. En déterminant la structure des protéines, les scientifiques peuvent créer des plans qui guideront le développement de médicaments plus efficaces, un peu comme les serruriers conçoivent des clés adaptées à des serrures spécifiques.
Bien qu’il soit bien connu que la température affecte la fonction moléculaire du corps, l’étude des protéines à température physiologique reste un défi technologique. L'étude réalisée par les laboratoires Du et Lü détaille comment ils ont surmonté ces problèmes et fournit aux scientifiques une feuille de route pour y parvenir dans leurs propres expériences.
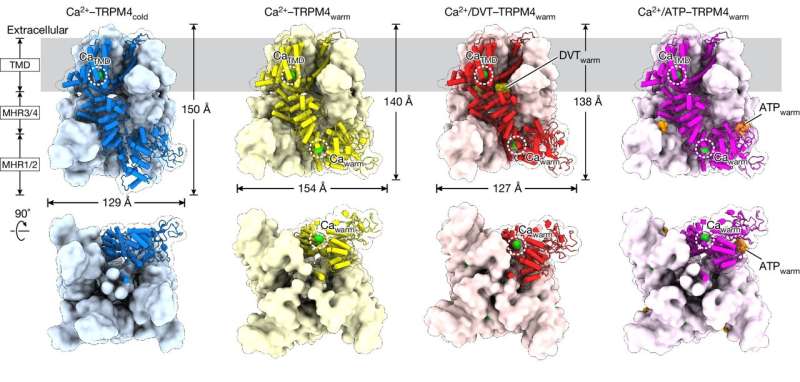
L’étude s’est concentrée sur une protéine appelée TRPM4, qui soutient la fonction cardiaque et le métabolisme, y compris la libération d’insuline. En tant que tel, TRPM4 est lié aux accidents vasculaires cérébraux, aux maladies cardiaques et au diabète, entre autres problèmes de santé.
Pour visualiser TRPM4 à la température corporelle, l'équipe a exploité la puissante suite de microscopes cryoélectroniques (cryo-EM) de VAI, qui permettent aux scientifiques de congeler des protéines et d'assembler des images détaillées de leurs structures. Plutôt que d'utiliser un échantillon à basse température, le chercheur postdoctoral Jinhong Hu, Ph.D., et ses collègues des laboratoires Du et Lü ont chauffé l'échantillon à la température corporelle avant de le surgeler. Ce faisant, ils ont découvert que les ligands (molécules qui se lient aux protéines) interagissent avec des sites totalement différents sur TRPM4 à la température corporelle qu'à des températures plus basses.
Les implications de l'étude d'aujourd'hui sont considérables et renforcent l'importance d'étudier les protéines à la température corporelle pour garantir l'identification des sites de liaison des médicaments physiologiquement pertinents.
D'autres auteurs incluent Sung Jin Park, Ph.D., Tyler Walter, Ph.D., Ian J. Orozco, Ph.D., Garrett O'Dea et Xinyu Ye de VAI. Les données cryo-EM ont été collectées au Cryo-EM Core de VAI et à la suite de cryo-microscopie électronique David Van Andel.
Plus d'informations : Jinhong Hu et al, La température physiologique détermine la reconnaissance et le déclenchement du ligand TRPM4, Nature (2024). DOI :10.1038/s41586-024-07436-7
Informations sur le journal : Nature
Fourni par l'Institut de recherche Van Andel