Crédit :Wikipédia
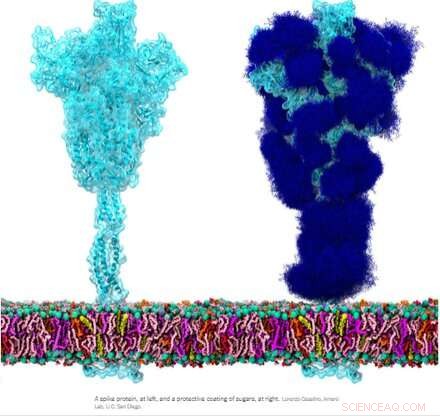
La glycoprotéine de pointe homotrimérique (S) du SRAS-CoV-2, en particulier sa sous-unité S2, est une protéine de fusion extraordinaire. Il peut fusionner des particules virales avec des cellules et également fusionner des cellules avec des cellules pour créer des syncytia multiformes parmi différents phénotypes cellulaires. Selon les versions exactes envisagées, la pointe peut accomplir ces exploits via de multiples mécanismes agissant à la fois sur les côtés intracellulaire et extracellulaire des membranes cellulaires.
Ces fonctions de fusion sont quelque peu analogues aux protéines ENV (enveloppe) homotrimères typiques comme notre protéine ENV rétrovirale endogène syncytine-1 et la glycoprotéine GP160 ENV du virus VIH. GP160, la protéine « pointe » du VIH, est finalement transformée au niveau de son propre site de clivage de la furine (également présent dans la syncytine-1) en une protéine GP120 et une protéine GP41, qui peuvent toutes deux adopter des configurations distinctes avant et après la fusion. Le génome du SRAS-CoV-2, cependant, spécifie déjà une petite protéine ENV distincte (commodément désignée par E), qui s'assemble dans un canal cationique présumé avec un pore de fusion central.
Il n'y a pas de gènes env, pol, gag ou pro définis comme tels pour le génome du SRAS-CoV-2, comme c'est le cas pour les rétrovirus, qui doivent s'intégrer dans notre ADN dans le cadre de leur cycle de vie. Curieusement, des chercheurs ont découvert que la protéine de pointe du SRAS-CoV-2, se comportant de son propre gré, participe directement à l'activation des rétrovirus endogènes dans nos cellules ce qui contribue à la pathologie observée. Que se passe-t-il exactement ici ?
À la lumière de certaines de ces similitudes, il a été suggéré que les anticorps générés contre la protéine de pointe pourraient potentiellement réagir de manière croisée dans tous les tissus susceptibles d'exprimer des protéines rétrovirales endogènes. En particulier, pendant la grossesse, après quoi les trophoblastes placentaires expriment des protéines ENV très utiles de nombreux HERV, notamment ERVW1 (syncytine-1), ERVFRD-1 (syncytine-2), ERVV-1, ERVV-2, ERVH48-1, ERVMER34-1 , ERV3-1 et ERVK13-1. Cependant, l'expression de la syncytine-2 dans les cytotrophoblastes villeux est fortement corrélée au degré de gravité de certaines pathologies placentaires telles que la prééclampsie.
Heureusement, les chercheurs ont découvert qu'il n'y a pratiquement aucune homologie de séquence directe entre la pointe et la syncytine-1, et peu de chances de réactivité croisée. Rédaction dans la revue Animal Cells and Systems , des chercheurs coréens ont testé un large panel d'anticorps monoclonaux et ont pu conclure que si d'anciennes reliques génomiques comme les HERV peuvent être activées dans divers tissus par le SARS-CoV-2, il n'y a aucun risque de réactivité croisée ou même d'infertilité.
Mais si la protéine de pointe est encore très capable de provoquer une fusion cellulaire indésirable, comment pouvons-nous mieux définir cette activité apparemment aléatoire, et de plus, que pouvons-nous faire à ce sujet ? Peut-être que la première étape consiste à devenir un peu plus sophistiqué avec la terminologie de la fusion cellulaire. Rédaction dans le journal Oncotarget , l'auteur Yuri Lazebnik offre quelques pistes de réflexion. Un syncytium produit à partir de cellules du même type, par exemple, comme dans la fusion de deux pneumocytes ou plus, est appelé homocaryon. Un hétérocaryon serait alors un syncytium fabriqué à partir, par exemple, d'un pneumocyte fusionné à un progéniteur épithélial, ou peut-être un leucocyte. En général, une fois que les cellules se combinent, tous les paris sont ouverts - si elles peuvent plus tard se trier et leurs noyaux pour générer une progéniture mononucléaire compétente pour la réplication est encore incomplètement connue.
Formation of spike-induced syncytia in the lungs of COVID-10 patients has been found in many forms, each with their own emergent properties that can contribute to disease sequelae. For example, ciliated cells in the airway, alveolar type 2 pneumocytes, and epithelial progenitors have all been found to participate in the oft-observed multinucleated 'giant cells.' Throw in a spike-laden leukocyte or two and things rapidly get hard to predict. Perhaps an even more alarming situation would be formation of a syncytium in the cells lining our blood vessels that could contribute to thrombosis. The ensuing death and eventual sloughing off of a patch of inappropriately fused cells could expose a sizeable region of thrombogenic basement membrane. A 20-micron fiber of collagen, the main component of the basement membrane, is sufficient to trigger platelet-dependent clotting.
But enough of this fear-mongering. Researchers have identified a set of already approved drugs that prevent spike-induced cell fusion and inhibit TMEM16F, a critical protein for syncytium formation. TMEM16F has the dual role of being a calcium-activated ion channel that regulates chloride secretion, as well as a lipid scramblase that relocates phosphatidylserine (PS) to the cell surface. This PS externalization is required for cell fusion in many systems, including spike-induced syncytia. Incidentally, scramblases also control the rate-limiting steps of the blood coagulation cascade, and may be the mechanism behind spike-induced thrombosis.
The blood coagulation pathways are a whole separate complex can of worms, but suffice it to say here that the primary trigger of coagulation induced by viral infections is the so-called extrinsic 'tenase.' Tenases are enzymes that process Factor X, or FX, (hence ten-ase), in the Tissue Factor (TF) activation pathway, which essentially act as the fuse for thrombus generation. The resulting complexes are assembled on externalized PS in the presence of calcium ions. TF is, in a sense, encrypted and so is unable to activate its downstream target factor FVIIa until it is de-encrypted by externalized PS.
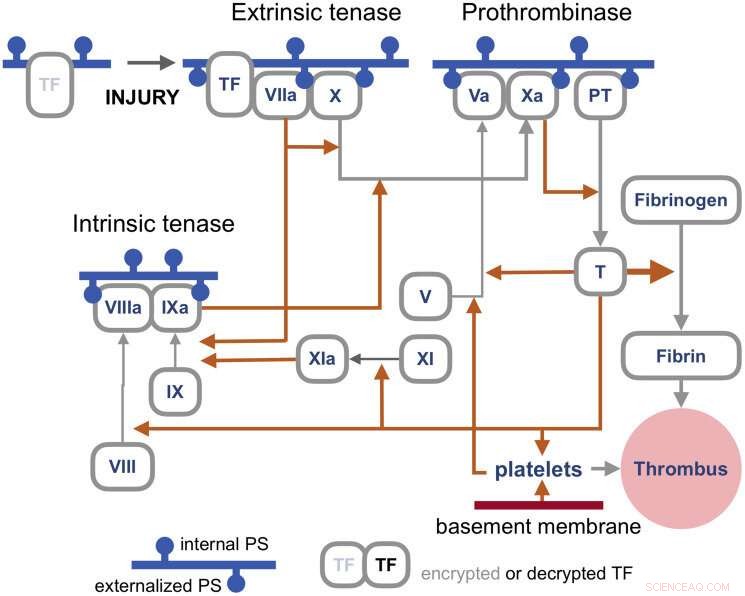
Coagulation pathways. Credit:Y. Lazebnik 2021
The realization that some fusogenic viral, or even retroviral proteins, which are fortuitously expressed in particular regions of the body may likely contribute to thrombotic events is of tremendous practical importance. One need look no further than Moderna's ample proposed pipeline for therapeutic mRNA-delivered amenities based on these proteins for all manner of viral insults to have some pause for inspection. There is certainly no shortage of methods currently employed for building antigenic spike proteins for vaccinations. Depending of how much of the spike code is used, which cleavage sequences are included, and which parts are stabilized, very different proteins can be made. It is probably fair to say that full-length spikes in large questionable vectors or inactivated viral particles have been largely de-emphasized in favor of smaller but more immunogenic concoctions.
Lungs and blood vessels are certainly critical areas of concern in any SARS-CoV-2 infection, but what our precious neurons—can spike fuse them as well? Clearly it can fuse neurons in brain organoids, but then again, what can't researchers do with these instant research publication miracles. In looking more braodly at other kinds of viruses, the fusion of neurons, glial cells, and even axons seems to be par for the course in causing a myriad constellation of potential neurological issues. For example, the pseudorabies virus bridges synapses to electrically couple the activity of neurons by fusing their axons. Fusions with glia have similarly been detected and linked with lasting neuropathic pain after the acute phase of herpes zoster (shingles). As of this Wednesday, we all are further aware that SARS-CoV-2 can utilize the protein vimentin as a way to infect endothelial cells. It should escape no one's notice, or at least that of the neuroscientists, that vimentin is the prime marker used for identifying glial cells.
Additionally, the rapidly expanding body of work looking at endogenous retrovirus re-activation in neurodegenerative disease further suggests to the rational mind that cell fusion may also be involved in this kind of pathology.