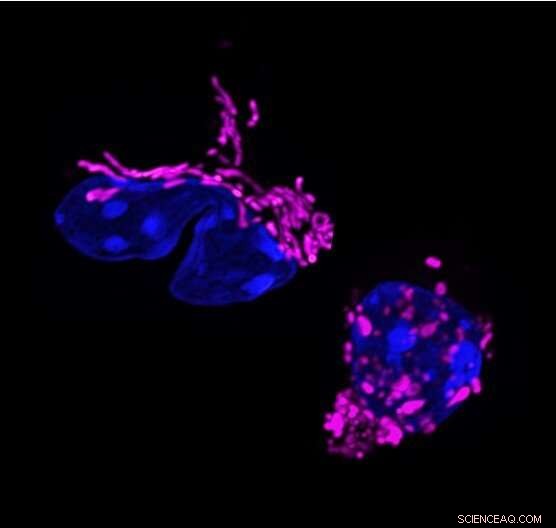
Changement de forme mitochondrial dans la réponse des lymphocytes T. Les changements dynamiques dans la forme mitochondriale sont liés à la fonction des lymphocytes T. Les cellules T auxiliaires 17 montrent des mitochondries allongées (colorées en violet, à gauche). L'élimination de la protéine de mise en forme de la membrane mitochondriale OPA1, fragmente les mitochondries dans les cellules T (à droite) et modifie la réponse des cellules T. Crédit :Francesc Baixauli
Une nouvelle étude portant sur les cellules Th17 du système immunitaire suggère que la forme et la fonction de leurs mitochondries sont importantes dans les maladies auto-immunes et inflammatoires, telles que la sclérose en plaques. Les cellules T helper 17 (Th17) sont un type de cellules immunitaires T CD4+, qui aident collectivement à fabriquer des anticorps, à activer les cellules dévoreuses d'ennemis et à recruter plus de soldats sur le front.
La recherche, dirigée par Erika Pearce, Ph.D., au Bloomberg~Kimmel Institute for Cancer Immunotherapy au Johns Hopkins Kimmel Cancer Center, suggère qu'apprendre comment les mitochondries impactent les cellules Th17 est essentiel pour comprendre comment les contrôler.
L'étude, publiée le 28 septembre dans la revue Nature , identifie plusieurs pistes pour tenter d'influencer le comportement de ces cellules importantes, dans le but d'atténuer leur activité auto-immune.
Lorsqu'une cellule T est exposée pour la première fois à un ennemi, elle répond aux signaux de l'ennemi et de l'environnement pour devenir l'un des nombreux types de cellules T spécialisées, chacune armée de fonctions distinctes dans la réponse immunitaire. Bien que tous les sous-types de cellules T auxiliaires soient cruciaux dans la lutte de l'organisme contre les étrangers, leur déséquilibre peut également provoquer des maladies, notamment le diabète de type 1, l'asthme, les allergies et l'inflammation chronique.
"Si nous pouvions contrôler les lymphocytes T, nous pourrions sans doute contrôler de nombreuses infections, auto-immunités et cancers, sinon la plupart", déclare Pearce, auteur principal de l'étude et professeur émérite Johns Hopkins Bloomberg au département d'oncologie et au département de biochimie et Biologie moléculaire.
L'étude a commencé lorsque des chercheurs du laboratoire de Pearce, qui se trouvait alors à l'Institut Max Planck de Fribourg, en Allemagne, ont remarqué un trait particulier aux cellules Th17. Parmi les trois principaux types de cellules effectrices T, seules les cellules Th17 avaient des mitochondries allongées ; c'est-à-dire que leurs centrales électriques internes ont été fusionnées en structures plus grandes. "C'était étrange car les mitochondries allongées sont généralement observées dans les cellules au repos et non dans les cellules activées", déclare le premier auteur Francesc Baixauli, Ph.D., ancien boursier postdoctoral à l'Institut Max Planck.
Les chercheurs savaient que le gène OPA1 régule la fusion mitochondriale, ils l'ont donc supprimé dans les cellules Th17 et ont découvert que leurs mitochondries revenaient à une taille et une forme plus fragmentées. Cependant, les cellules ont également cessé de faire leur travail principal :produire la molécule de signalisation interleukine-17 (IL-17).
Pour confirmer ce résultat dans un organisme, les chercheurs ont supprimé le gène OPA1 chez la souris et promu une maladie chez ces animaux qui modélise la sclérose en plaques humaine, qui est provoquée par leurs cellules Th17. Avec OPA1 supprimé, non seulement leurs cellules ont cessé de produire de l'IL-17, mais leurs symptômes de la maladie ont diminué.
Se demandant comment la suppression d'OPA1 a arrêté la production d'IL-17, l'équipe a d'abord pensé que les mitochondries des cellules ne produisaient tout simplement pas assez d'énergie. Cependant, ils ont découvert que la suppression d'OPA1 n'affectait pas la production d'énergie et qu'OPA1 était cruciale pour la production d'IL-17, que l'activité métabolique des cellules soit élevée ou faible. Ensuite, ils ont découvert qu'un processus biochimique central se produisant dans les mitochondries avait été altéré, provoquant l'accumulation d'un métabolite connu pour influencer l'ADN et le programme transcriptionnel de la cellule. "Cette molécule diminuait la capacité de la cellule à lire son ADN, et par conséquent l'IL-17 n'était plus produite", explique Baixauli.
Pour identifier le lien entre ces réponses et la suppression d'OPA1, les chercheurs ont comparé les protéines produites par les cellules Th17 normales et celles sans OPA1. Dans les cellules dépourvues d'OPA1, ils ont constaté une forte augmentation de la forme activée de la protéine LKB1, qui est un capteur métabolique qui régule le métabolisme cellulaire, la division cellulaire et la fonction mitochondriale. Lorsqu'ils ont supprimé à la fois OPA1 et LKB1 des cellules, la production d'IL-17 a été restaurée et les processus mitochondriaux sont revenus à la normale.
"Nous pensons que LKB1 détecte le stress mitochondrial et modifie les réactions biochimiques des mitochondries de manière appropriée, ce qui affecte la production d'IL-17", explique Pearce. "Nous avons maintenant une courte liste de molécules connues pour influencer cet aspect clé de la fonction Th17, qui peut être le point de basculement entre ses rôles utiles et nocifs. Nos futures recherches continueront d'explorer ces relations afin que nous puissions, espérons-le, un jour modifier thérapeutiquement leur." Une étude révèle le rôle principal des mitochondries à changement de forme dans la fonction des cellules souches