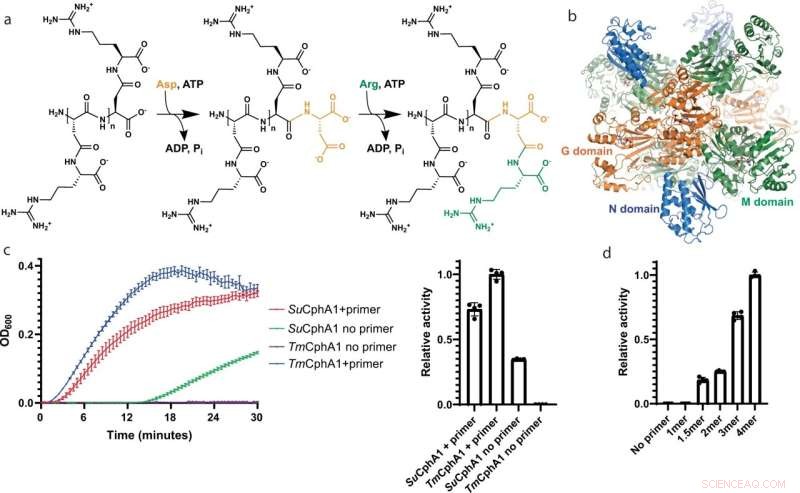
Structure et activité de CphA1. un Diagramme schématique des réactions de biosynthèse catalysées par les domaines G et M de CphA1. b La structure globale de CphA1 tétramérique de Synechocystis sp. UTEX2470 (Su CphA1, code APB 7LG5). Les molécules d'ATP marquent les positions des sites actifs des domaines G (orange) et M (vert). Le domaine N est coloré en bleu. c Graphiques de biosynthèse de la cyanophycine et comparaison des taux de synthèse par Su CphA1 et Tm CphA1 avec et sans amorce. Tm CphA1 est complètement inactif en l'absence d'amorce. n = 4 expériences indépendantes. Les données sont présentées sous forme de mesures individuelles et de valeur moyenne, les barres d'erreur représentent les valeurs SD. d Niveaux d'activité de Tm CphA1 en présence de diverses amorces de cyanophycine :1mer (β-Asp-Arg)1 , 1.5mer (β-Asp-Arg)-Asp, 2mer (β-Asp-Arg)2 , 3mer (β-Asp-Arg)3 , 4mer (β-Asp-Arg)4 . n = 4 expériences indépendantes. Les données sont présentées sous forme de mesures individuelles et de valeur moyenne, les barres d'erreur représentent les valeurs SD. Crédit :Nature Communications (2022). DOI :10.1038/s41467-022-31542-7
Les algues bleu-vert (cyanobactéries AKA) ont un super pouvoir qui les aide probablement à réussir en tant qu'envahisseurs des cours d'eau. Ils ont une capacité extraordinaire à stocker de l'énergie et de l'azote dans leurs cellules en cas de besoin. Mais comment exactement ils le font reste seulement partiellement compris.
Des chercheurs de l'Université McGill et leurs collaborateurs de l'ETH Zurich ont découvert une capacité intrigante jusqu'ici inconnue des enzymes (connues sous le nom de cyanophycine synthétases) qui sont actives dans la création de ces réserves alimentaires. Leurs découvertes, décrites dans un article récent dans Nature Communications , sont non seulement scientifiquement surprenants, mais nous rapprochent également de la possibilité d'utiliser ces polymères respectueux de l'environnement pour tout, des pansements aux antitartres biodégradables en passant par les aliments pour animaux.
Les enzymes telles que les cyanophycine synthétases (appelées enzymes polymérases car elles synthétisent de longues chaînes de polymères) nécessitent généralement des amorces sous la forme de courtes "chaînes de démarrage" pour commencer à assembler les longues chaînes. Les polymérases agissent comme des catalyseurs pour un large éventail de fonctions biologiques, du démarrage du processus de réplication de l'ARN et de l'ADN à la conversion du glucose en glycogène comme moyen de stocker de l'énergie pour une utilisation ultérieure. On pensait que les synthétases de cyanophycine de nombreuses cyanobactéries différentes avaient besoin d'amorces comme toutes les autres polymérases, mais les chercheurs ont ensuite découvert quelque chose de nouveau.
"Nous travaillions avec plusieurs synthétases de cyanophycine et avons constaté que l'une d'entre elles n'avait pas besoin de recevoir d'amorce", explique l'auteur principal Itai Sharon, titulaire d'un doctorat de McGill. étudiant en biochimie. "Après trois ans d'expériences, essayant de comprendre pourquoi pas, nous avons découvert que cette cyanophycine synthétase avait un centre de réaction caché en son sein qui clive les liaisons entre les acides aminés, au lieu de lier les acides aminés, ce qui est le travail principal de cette polymérase."
Contrairement à toutes les polymérases connues
Les chercheurs ont découvert que la cyanophycine synthétase pouvait fabriquer lentement un très petit nombre de longs polymères de cyanophycine en l'absence d'amorce, que le centre de réaction nouvellement découvert clive en de nombreuses chaînes courtes qui sont ensuite utilisées comme amorces pour une polymérisation rapide.
« Nous appelons la cyanophycine synthétase une « enzyme couteau suisse », déclare Martin Schmeing, auteur correspondant et directeur du Centre de recherche en biologie structurale de McGill. « Elle combine trois fonctions enzymatiques – deux de création de liaisons et une de rupture de liaisons – en une seule , machine de polymérisation autonome."
"Ce qui le rend encore plus spécial, c'est que ces polymérases ont été étudiées par de nombreux chercheurs pendant des décennies et des décennies. Personne, y compris nous, ne l'avait remarqué auparavant." Comment les bactéries créent une tirelire pour les périodes de vaches maigres