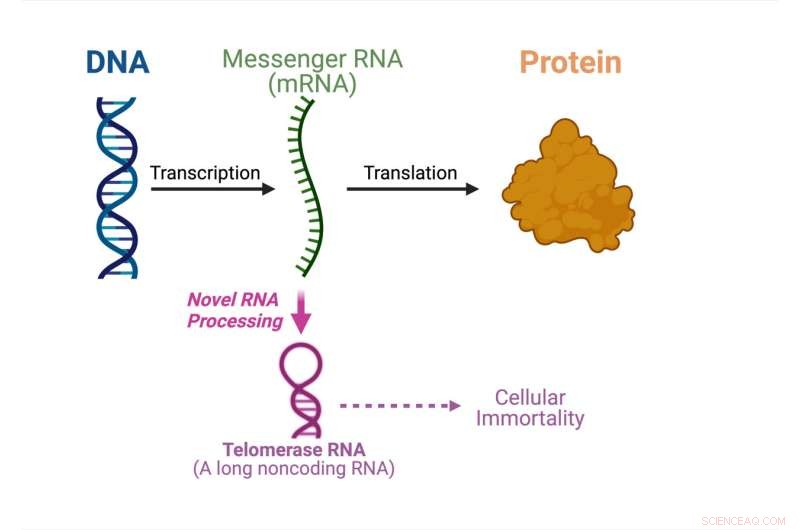
Le dogme central de la biologie moléculaire montrant ce qui se passe dans cette étude. Crédit :Julian Chen
Pour la toute première fois, une étude menée par Julian Chen et son groupe à la School of Molecular Sciences de l'Arizona State University et au Biodesign Institute's Center for the Mechanism of Evolution, a découvert une voie sans précédent produisant de l'ARN télomérase à partir d'un ARN messager codant pour une protéine ( ARNm).
Le dogme central de la biologie moléculaire spécifie l'ordre dans lequel l'information génétique est transférée de l'ADN pour fabriquer des protéines. Les molécules d'ARN messager transportent l'information génétique de l'ADN du noyau de la cellule au cytoplasme où les protéines sont fabriquées. L'ARN messager agit en tant que messager pour construire des protéines.
"En fait, il existe de nombreux ARN (acides ribonucléiques) qui ne sont pas utilisés pour fabriquer des protéines", a expliqué Chen. "Environ 70 % du génome humain est utilisé pour fabriquer des ARN non codants qui ne codent pas pour des séquences protéiques mais qui ont d'autres usages."
L'ARN de la télomérase est l'un des ARN non codants qui s'assemble avec les protéines de la télomérase pour former l'enzyme télomérase. La télomérase est cruciale pour l'immortalité cellulaire dans le cancer et les cellules souches. Dans cette étude, le groupe de Chen montre qu'un ARN de télomérase fongique est traité à partir d'un ARNm codant pour une protéine, au lieu d'être synthétisé indépendamment.
"La découverte de cet article change de paradigme. La plupart des molécules d'ARN sont synthétisées indépendamment et nous avons découvert ici un ARNm à double fonction qui peut être utilisé pour produire une protéine ou pour fabriquer un ARN de télomérase non codant, ce qui est vraiment unique", a déclaré Chen. "Nous devrons faire beaucoup plus de recherches pour comprendre le mécanisme sous-jacent d'une voie de biogenèse de l'ARN aussi inhabituelle."
La recherche fondamentale sur le métabolisme et la régulation de l'ARNm a conduit à d'importantes applications médicales. Par exemple, plusieurs vaccins COVID-19 utilisent l'ARN messager comme moyen de produire des protéines de pointe virales. Dans ces vaccins, les molécules d'ARNm sont finalement dégradées puis absorbées par notre corps.
Cette nouvelle approche présente des avantages par rapport aux vaccins à ADN qui courent le risque potentiel d'être incorporés de manière délétère et permanente dans notre ADN. La découverte de la biogenèse de l'ARNm à double fonction dans ce travail pourrait conduire à des moyens innovants de fabriquer de futurs vaccins à ARNm.
Dans cette étude, le groupe de Chen a découvert l'ARN inattendu de la télomérase dérivé de l'ARNm dans l'organisme fongique modèle Ustilago maydis ou charbon de maïs. Le charbon de maïs, également appelé truffe mexicaine, est comestible et ajoute un délicieux effet umami à de nombreux plats, par exemple les tamales et les tacos. L'étude de la biologie de l'ARN et des télomères dans le charbon du maïs peut fournir des opportunités pour trouver de nouveaux mécanismes pour le métabolisme de l'ARNm et la biogenèse de la télomérase.
Pourquoi étudier l'ARN de la télomérase ?
Le prix Nobel de physiologie ou médecine a été décerné en 2009 "pour la découverte de la protection des chromosomes par les télomères et l'enzyme télomérase". La télomérase a d'abord été isolée d'un organisme unicellulaire vivant dans l'écume des étangs. Comme il s'est avéré plus tard, la télomérase existe dans presque tous les organismes eucaryotes, y compris les humains, et joue un rôle crucial dans le vieillissement et le cancer. Les scientifiques se sont efforcés de découvrir des moyens d'utiliser la télomérase pour rendre les cellules humaines immortelles.
Les cellules humaines typiques sont mortelles et ne peuvent pas se renouveler indéfiniment. Comme l'a démontré Leonard Hayflick il y a un demi-siècle, les cellules humaines ont une durée de vie réplicative limitée, les cellules plus âgées atteignant cette limite plus tôt que les cellules plus jeunes. Cette "limite Hayflick" de la durée de vie cellulaire est directement liée au nombre de répétitions d'ADN uniques trouvées aux extrémités des chromosomes porteurs de matériel génétique. Ces répétitions d'ADN font partie des structures de coiffage protectrices, appelées "télomères", qui protègent les extrémités des chromosomes contre les réarrangements d'ADN indésirables et injustifiés qui déstabilisent le génome.
Chaque fois que la cellule se divise, l'ADN télomérique rétrécit et finira par échouer à sécuriser les extrémités des chromosomes. Cette réduction continue de la longueur des télomères fonctionne comme une "horloge moléculaire" qui compte à rebours jusqu'à la fin de la croissance cellulaire.
La capacité réduite des cellules à se développer est fortement associée au processus de vieillissement, la population cellulaire réduite contribuant directement à la faiblesse, à la maladie et à la défaillance des organes.
Contrer le processus de rétrécissement des télomères est la télomérase, l'enzyme qui détient de manière unique la clé pour retarder ou même inverser le processus de vieillissement cellulaire. La télomérase compense le vieillissement cellulaire en allongeant les télomères, en ajoutant des répétitions d'ADN perdues pour ajouter du temps au compte à rebours de l'horloge moléculaire, prolongeant ainsi efficacement la durée de vie de la cellule.
La télomérase allonge les télomères en synthétisant à plusieurs reprises de très courtes répétitions d'ADN de six nucléotides - les éléments constitutifs de l'ADN - avec la séquence "GGTTAG" sur les extrémités des chromosomes à partir d'une matrice située dans le composant ARN de l'enzyme elle-même.
Le rétrécissement progressif des télomères affecte négativement la capacité réplicative des cellules souches humaines, les cellules qui restaurent les tissus endommagés et/ou reconstituent les organes vieillissants de notre corps. L'activité de la télomérase dans les cellules souches adultes ne fait que ralentir le compte à rebours de l'horloge moléculaire et n'immortalise pas complètement ces cellules. Par conséquent, les cellules souches adultes s'épuisent chez les personnes âgées en raison du raccourcissement de la longueur des télomères, ce qui entraîne une augmentation des temps de guérison et une dégradation des tissus organiques à partir de populations cellulaires inadéquates.
Exploiter tout le potentiel de la télomérase
Comprendre la régulation et la limitation de l'enzyme télomérase promet d'inverser le raccourcissement des télomères et le vieillissement cellulaire avec le potentiel de prolonger la durée de vie humaine et d'améliorer le bien-être des personnes âgées.
Les maladies humaines telles que la dyskératose congénitale, l'anémie aplasique et la fibrose pulmonaire idiopathique ont été génétiquement liées à des mutations qui affectent négativement l'activité de la télomérase et/ou accélèrent la perte de longueur des télomères. Ce raccourcissement accéléré des télomères ressemble étroitement au vieillissement prématuré avec une détérioration accrue des organes et une durée de vie raccourcie du patient causée par des populations de cellules souches extrêmement insuffisantes. L'augmentation de l'activité de la télomérase est apparemment le moyen le plus prometteur de traiter ces maladies génétiques.
Alors qu'une activité accrue de la télomérase pourrait amener les jeunes à vieillir les cellules et guérir les maladies prématurées semblables au vieillissement, trop d'une bonne chose peut être préjudiciable pour l'individu. Tout comme les cellules souches jeunes utilisent la télomérase pour compenser la perte de longueur des télomères, les cellules cancéreuses utilisent la télomérase pour maintenir leur croissance aberrante et destructrice. L'augmentation et la régulation de la fonction de la télomérase devront être effectuées avec précision, en marchant sur une ligne étroite entre le rajeunissement cellulaire et un risque accru de développement de cancer.
Distinctes des cellules souches humaines, les cellules somatiques constituent la grande majorité des cellules du corps humain et sont dépourvues d'activité télomérase. Le déficit en télomérase des cellules somatiques humaines réduit le risque de développement du cancer, car la télomérase alimente la croissance incontrôlée des cellules cancéreuses. Par conséquent, les médicaments qui augmentent l'activité de la télomérase sans distinction dans tous les types de cellules ne sont pas souhaités. Les médicaments à petites molécules peuvent être criblés ou conçus pour augmenter l'activité de la télomérase exclusivement dans les cellules souches pour le traitement des maladies ainsi que les thérapies anti-âge sans augmenter le risque de cancer.
L'étude de la biogenèse de l'ARN de la télomérase dans le charbon du maïs pourrait dévoiler de nouveaux mécanismes de régulation de la télomérase et offrir de nouvelles orientations sur la façon de moduler ou de concevoir la télomérase humaine pour des innovations dans le développement de thérapies anti-âge et anticancéreuses.
Cette étude, "Biogenèse de l'ARN de la télomérase à partir d'un précurseur d'ARNm codant pour une protéine", vient d'être publiée dans les Proceedings of the National Academy of Sciences . L'équipe de l'ASU comprend les premiers auteurs postdoc Dhenugen Logeswaran et l'ancien professeur assistant de recherche Yang Li, la doctorante Khadiza Akhter, l'ancien postdoc Joshua Podlevsky (actuellement au Sandia National Labs, Albuquerque, Nouveau-Mexique) et deux étudiants de premier cycle Tamara Olson et Katherine Fosberg.
Chen a également commenté le calibre des étudiants de premier cycle de l'ASU, Tamara Olson et Katherine Fosberg, qui travaillaient dans son laboratoire depuis plus d'un an. "Ils ont passé beaucoup de temps au laboratoire et ont été pleinement impliqués dans nos recherches." Ce que les homards peuvent nous apprendre sur l'immortalité