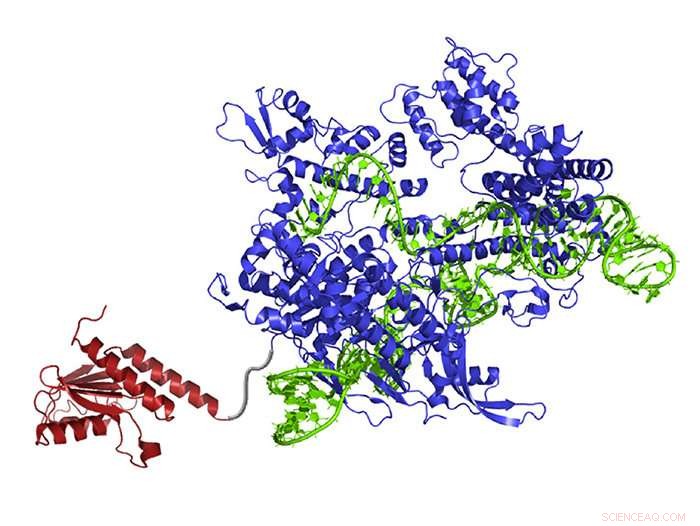
Un éditeur de base d'ADN nouvellement créé contient une enzyme de réarrangement des atomes (rouge) qui peut transformer l'adénine en inosine (lue et copiée en tant que guanine), ARN guide (vert) qui dirige la molécule au bon endroit, et Cas9 nickase (bleu), qui coupe le brin d'ADN opposé et incite la cellule à échanger la base complémentaire. Crédit :Gaudelli et al./ La nature 2017
Des scientifiques de l'Université Harvard et du Broad Institute du MIT et de Harvard ont développé une nouvelle classe d'outils d'édition du génome. Ce nouvel "éditeur de base" peut directement réparer le type de modifications d'une seule lettre dans le génome humain qui représentent environ la moitié des mutations ponctuelles associées aux maladies humaines. Ces mutations sont associées à des troubles allant de la cécité génétique à la drépanocytose en passant par des troubles métaboliques et la mucoviscidose.
L'équipe de recherche, dirigé par David Liu, professeur de chimie et de biologie chimique à l'Université Harvard, membre principal de l'institut au Broad Institute, et un chercheur du Howard Hughes Medical Institute (HHMI), développé une machine moléculaire capable de convertir la paire de bases d'ADN A* T en G* C, sans couper la double hélice, avec une efficacité élevée et pratiquement aucun produit indésirable. Le développement est un ajout important à la suite croissante d'outils d'édition du génome.
Le nouveau système est décrit dans un article publié aujourd'hui dans La nature . En plus de Liu, l'étude a été dirigée par Nicole Gaudelli, un stagiaire postdoctoral dans le laboratoire de Liu; Alexis Komor, un ancien boursier postdoctoral dans le laboratoire de Liu qui est maintenant professeur adjoint à l'UCSD; Holly Rees, étudiante diplômée; anciens étudiants diplômés Michael Packer et Ahmed Badran, et l'ancien boursier postdoctoral David Bryson.
Le nouveau système, surnommé Adenine Base Editor, ou ABE, peut être programmé pour cibler une paire de bases spécifique dans un génome à l'aide d'un ARN guide et d'une forme modifiée de CRISPR-Cas9. Il fonctionne en réarrangeant les atomes dans une adénine cible (A) - l'une des quatre bases qui composent l'ADN - pour ressembler à la guanine (G), puis en incitant les cellules à fixer l'autre brin d'ADN pour terminer la conversion de paires de bases, rendre le changement permanent. Par conséquent, ce qui était une paire de bases A*T devient une paire de bases G*C.
Non seulement le système est très efficace par rapport à d'autres techniques d'édition du génome pour corriger les mutations ponctuelles, mais il n'y a pratiquement pas de sous-produits détectables tels que des insertions aléatoires, suppressions, déménagements, ou d'autres conversions de base à base.
Il est important d'apporter ce changement spécifique car environ la moitié des 32, Les milliers de mutations ponctuelles associées à la maladie déjà identifiées par les chercheurs sont un changement de G* C en A* T.
« Nous avons développé un nouvel éditeur de base, une machine moléculaire, qui, dans un irréversible, efficace, et propre peut corriger ces mutations dans le génome des cellules vivantes, " dit Liu, qui est également professeur Richard Merkin et directeur du Merkin Institute of Transformative Technologies in Healthcare at the Broad. "Lorsqu'ils sont ciblés sur certains sites de l'ADN génomique humain, cette conversion inverse la mutation qui est associée à une maladie particulière."
ABE rejoint d'autres systèmes d'édition de base mis au point dans le laboratoire de Liu, tels que BE3 et sa variante améliorée, BE4. En utilisant ces éditeurs de base, les chercheurs peuvent désormais corriger toutes les mutations dites de « transition » – C à T, T à C, A à G, ou G à A - qui représentent ensemble près des deux tiers de toutes les mutations ponctuelles causant la maladie, y compris beaucoup qui causent des maladies graves pour lesquelles il n'existe aucun traitement actuel. Des recherches supplémentaires sont nécessaires, Liu note, pour permettre à l'ABE de cibler le plus possible le génome, comme Liu et ses étudiants l'ont déjà réalisé grâce à des variantes d'ingénierie de BE3.
Le développement du nouvel éditeur de base a commencé lorsque l'équipe a entamé un effort d'un an pour développer une nouvelle enzyme capable de convertir l'adénine en inosine (I), un nucléotide qui se comporte de manière similaire à G lors de la synthèse d'ADN ou d'ARN. Le projet, dirigé par Gaudelli, a finalement abouti à des performances élevées, ABE de septième génération.
"Le principal défi pour moi lors du développement d'ABE était de surmonter l'obstacle psychologique de savoir si ABE pouvait ou non passer du concept à la réalité, puisque le composant clé de l'éditeur n'existait pas naturellement et devait évoluer dans notre laboratoire, " a déclaré Gaudelli. " Il était important de garder la foi que nous ne pouvions pas seulement rêver d'une telle machine moléculaire, mais aussi le construire."
Pour démontrer le potentiel d'ABE, Liu et ses collègues ont d'abord utilisé l'ABE pour corriger directement une mutation qui provoque l'hémochromatose héréditaire (HHC) dans les cellules humaines.
Ils ont également utilisé l'ABE pour installer une mutation dans les cellules humaines qui supprime une maladie, recréer la soi-disant « mutation britannique » trouvée chez des individus en bonne santé qui développeraient normalement des maladies du sang comme la drépanocytose, mais qui auraient plutôt une mutation qui fait que les gènes de l'hémoglobine fœtale restent actifs après la naissance, les protégeant des maladies du sang.
Alors que le développement d'ABE est un pas en avant passionnant dans l'édition de base, il reste encore du travail avant que l'édition de base puisse être utilisée pour traiter les patients atteints de maladies génétiques, y compris les tests de sécurité, efficacité, et effets secondaires.
"Créer une machine qui effectue le changement génétique dont vous avez besoin pour traiter une maladie est un pas en avant important, mais ce n'est qu'une partie de ce qui est nécessaire pour traiter un patient, " dit Liu. " Nous devons encore livrer cette machine, nous devons tester sa sécurité, nous devons évaluer ses effets bénéfiques chez les animaux et les patients et les comparer aux effets secondaires, nous devons faire beaucoup plus de choses. »
"Mais avoir la machine est un bon début."