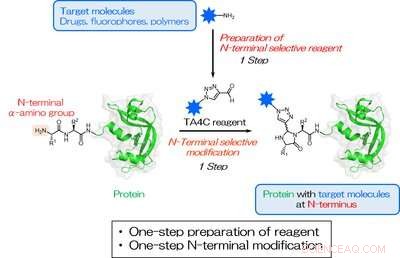
Fig. 1. Une préparation en une étape de TA4C et une bioconjugaison en une étape ciblant un groupe N-terminal a-amino. L'étoile bleue représente une molécule cible pour la modification N-terminale. Crédit :Université d'Osaka
Les protéines sont largement utilisées en médecine, biologie et chimie. L'amélioration de leurs propriétés inhérentes en ajoutant des molécules fonctionnelles à leurs structures est une étape courante et importante dans de nombreux domaines. Par exemple, l'ajout de molécules fluorescentes permet de tracer et de quantifier les protéines. De nombreuses stratégies de modification avec divers avantages ont été décrites. Les chercheurs de l'Université d'Osaka rapportent maintenant une simple modification spécifique à l'extrémité N effectuée dans des conditions douces à l'aide de nouveaux réactifs préparés en une seule étape. Leurs conclusions ont été publiées en ligne dans ChemBioChem .
L'extrémité N est définie comme le début de la chaîne protéique où le groupe amino du premier bloc de construction d'acides aminés est disponible pour réagir. Le ciblage spécifique de l'extrémité N est utile car il est rarement impliqué dans le repliement des protéines, le rendant facilement accessible tout en ayant un impact minimal sur la fonction des protéines. Il est connu pour être un site unique et toujours présent au sein de chaque protéine.
Inspiré des travaux antérieurs, les chercheurs ont passé au crible une série de composés azotés cycliques et ont découvert que 1H-1, 2, Les dérivés 3-triazole-4-carbaldéhyde (TA4C) peuvent être conjugués à l'extrémité N-terminale en une seule étape avec des conversions relativement élevées, jusqu'à 92%.
« La simplification de la modification des protéines est un développement précieux pour une variété de domaines, ", explique l'auteur correspondant Akira Onoda. "Notre approche permet un étiquetage spécifique au site très efficace dans des conditions douces, ce qui est important lorsque l'on travaille avec des molécules biologiques sensibles. Tant que la molécule à ajouter contient un groupe amino, une réaction peut être effectuée pour créer le groupe TA4C en une seule étape, qui est alors réactif envers la protéine N terminale."
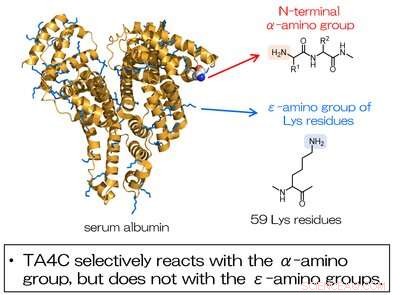
Fig. 2. La modification de l'albumine sérique à l'aide de TA4C s'effectue sélectivement au niveau du groupe a-amino N-terminal et non au niveau des groupes amino des résidus Lys. Crédit :Université d'Osaka
Les réactifs TA4C sont préparés en une seule étape à partir d'une molécule fonctionnelle avec un groupe amino via une réaction connue sous le nom de réarrangement de Dimroth. Diverses molécules contenant des amines ont été utilisées avec succès, dont le polyéthylène glycol, biotine, et la fluorescéine, démontrant le large éventail de fonctionnalités possibles.
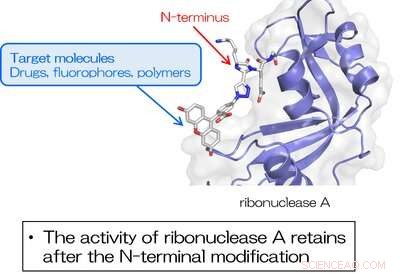
Fig. 3. La RNase A modifiée à l'extrémité N-terminale à l'aide de TA4C conserve l'activité enzymatique inhérente. Crédit :Université d'Osaka
"Nous pensons que notre approche contribuera en tant qu'option extrêmement pratique à la boîte à outils de modification des protéines et accélérera le développement dans de nombreux domaines qui reposent sur la conjugaison des protéines, ", explique l'auteur correspondant Takashi Hayashi. "En outre, combiner notre approche avec des techniques ciblant d'autres sites protéiques permettra d'introduire de multiples fonctions, offrant une grande flexibilité. Cela s'avérera bénéfique dans une grande variété de domaines, y compris la bio-ingénierie, médicaments, et diagnostiques."