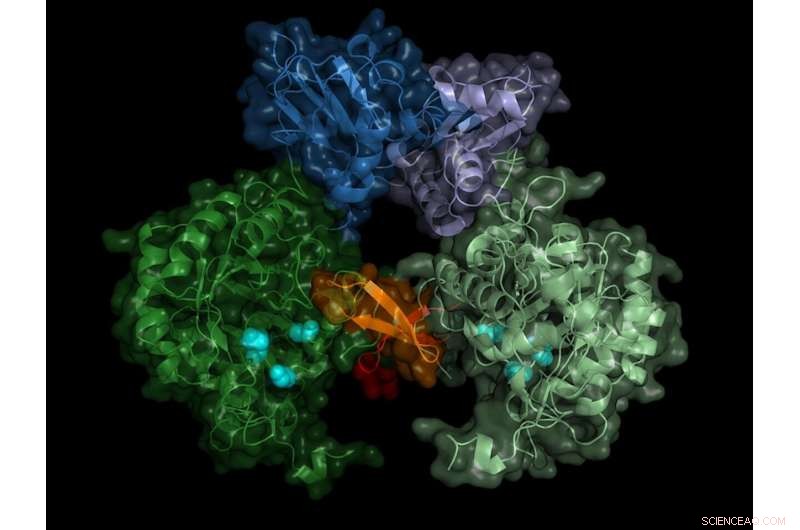
Structure de la déshydrogénase IMP du parasite. L'enzyme active forme des paires (dimères), la région "switch" (région Bateman) est représentée en nuances de bleu. Crédit :Université de Lübeck/DESY, Lars Redecke
Grâce à des flashs à rayons X ultra-lumineux, une équipe de chercheurs a traqué une cible potentielle pour de nouveaux médicaments contre la maladie du sommeil :les scientifiques ont décodé la structure spatiale détaillée d'une enzyme vitale du pathogène, le parasite Trypanosoma brucei. Le résultat fournit un modèle possible pour un médicament qui bloque spécifiquement cette enzyme et tue ainsi le parasite, comme l'équipe dirigée par Christian Betzel de l'Université de Hambourg, Lars Redecke de l'Université de Lübeck et DESY, et Henry Chapman de DESY rapporte dans le journal Communication Nature .
La maladie du sommeil (trypanosomiase africaine) est une maladie tropicale causée par le parasite Trypanosoma brucei, qui est transmis par la piqûre des mouches tsé-tsé, qui habitent une grande partie de l'Afrique tropicale. Dans le corps, le parasite se multiplie d'abord sous la peau, dans le sang et dans le système lymphatique, puis migre vers le système nerveux central. Si laissé non traité, la maladie est presque toujours mortelle. Grâce à des mesures de contrôle intensives, le nombre de cas enregistrés a considérablement diminué ces dernières années. Néanmoins, la maladie du sommeil est toujours considérée comme l'une des maladies tropicales les plus importantes. Selon l'Organisation mondiale de la santé, plus de 60 millions de personnes dans les zones rurales d'Afrique subsaharienne sont en danger. Guerre, les déplacements et les migrations peuvent provoquer une poussée de la maladie.
Dans la recherche d'un point de départ possible pour les médicaments contre l'agent pathogène, les chercheurs avaient ciblé une enzyme centrale de l'organisme unicellulaire, l'inosine-5'-monophosphate déshydrogénase (IMPDH). « Cette enzyme appartient à l'inventaire central de tout organisme et constitue une cible intéressante pour les médicaments car elle régule la concentration de deux nucléotides vitaux dans la cellule :la guanosine diphosphate et la guanosine triphosphate, " dit Redecke. " La cellule a besoin de ces nucléotides pour fournir de l'énergie et construire des structures plus grandes telles que le génome. Si vous interrompez ce cycle, la cellule meurt."
L'enzyme a une sorte d'interrupteur marche/arrêt qui est activé par l'amarrage des propres molécules de la cellule. Une approche prometteuse consiste à bloquer ce commutateur avec une molécule précisément adaptée. Pour construire un tel inhibiteur, la structure spatiale exacte du commutateur doit être connue. Les biologistes structurels peuvent déterminer la structure des biomolécules à l'aide de rayons X. Pour faire ça, ils font d'abord croître de petits cristaux à partir des biomolécules, qui génèrent ensuite des motifs de diffraction caractéristiques lorsqu'ils sont éclairés par des rayons X. A partir de ces modèles, la structure atomique du cristal et ses blocs de construction, les biomolécules, peut être calculé.
Cette approche est souvent compliquée par l'intraitabilité de la plupart des biomolécules contre la formation de cristaux. Et si de tels cristaux peuvent être cultivés, ils sont généralement extrêmement sensibles aux rayons X de haute énergie et sont rapidement détruits. "Bien que les structures de nombreuses déshydrogénases IMP soient déjà connues, il n'y avait pas eu de succès dans la croissance de cristaux de la version Trypanosoma brucei de l'enzyme, " rapporte Betzel, qui est également chercheur dans le Pôle d'Excellence CUI :Advanced Imaging of Matter à l'Université de Hambourg et DESY.

La maladie est transmise par la mouche tsé-tsé. Crédit :CDC, Kay DeWitt (domaine public)
L'équipe a donc choisi une voie alternative :le groupe du co-auteur Michael Duszenko de l'université de Tübingen a induit certaines cellules d'insectes à cristalliser des biomolécules en leur sein. Grâce à cette cristallisation dite in cellulo, la même équipe avait déjà déchiffré une autre enzyme clé du pathogène de la maladie du sommeil, cathepsine B, qui est également une cible potentielle de médicament. Il s'est avéré que les cellules d'insectes modifiées produisent également des cristaux de la déshydrogénase actuellement étudiée. Ces cristaux forment de minuscules aiguilles d'environ 5 millièmes de millimètre (5 micromètres) d'épaisseur et jusqu'à 70 micromètres de long, de sorte qu'ils dépassaient des cellules productrices.
Les cristaux in-cellulo sont si petits que des rayons X très brillants sont nécessaires pour les analyser. Plus un cristal est gros, plus il y a d'atomes à l'intérieur qui peuvent diffuser des rayons X, provoquant un meilleur diagramme de diffraction. Les chercheurs ont donc utilisé le laser à rayons X LCLS du SLAC National Accelerator Laboratory aux États-Unis pour l'analyse. « Les lasers à rayons X génèrent des flashs extrêmement intenses, " explique Chapman, qui est Lead Scientist à DESY au Centre for Free-Electron Laser Science CFEL et l'un des porte-parole du Cluster of Excellence CUI :Advanced Imaging of Matter. "Bien que les cristaux sensibles s'évaporent immédiatement, ils génèrent d'abord une figure de diffraction à partir de laquelle la structure peut être obtenue." La méthode utilisée ici pour exploiter ces propriétés, appelée cristallographie femtoseconde en série, a été développé plus tôt par de nombreux chercheurs impliqués dans cette étude et nommé l'une des dix meilleures avancées de l'année par le magazine Science en 2013.
L'équipe a enregistré les diagrammes de diffraction de plus de 22, 000 microcristaux et a pu calculer la structure spatiale de l'enzyme avec une précision de 0,28 millionième de millimètre (nanomètre) - cela correspond à peu près au diamètre d'un atome d'aluminium. "Le résultat ne montre pas seulement la structure exacte du commutateur enzymatique, la région de Bateman, mais aussi quelles molécules de la cellule activent le commutateur et comment ces soi-disant cofacteurs se lient au commutateur enzymatique, " rapporte Karol Nass qui a effectué ce travail pendant ses études de doctorat à DESY. Il travaille maintenant à l'Institut Paul Scherrer en Suisse et est, avec Redecke, un auteur principal de la publication.
Le commutateur est actionné par les molécules d'adénosine triphosphate (ATP) et de guanosine monophosphate (GMP). "L'avantage de notre méthode n'est pas seulement que nous sommes capables d'étudier l'enzyme à température ambiante, auquel l'enzyme fonctionne naturellement, mais aussi que lors de la cristallisation in cellulo les cofacteurs naturels se lient à l'enzyme, " a déclaré Betzel. Selon le chercheur, les données pourraient maintenant fournir une approche pour inhiber la déshydrogénase IMP du parasite. "On pourrait penser à construire une sorte de fermoir qui couvrirait les sites de liaison des deux cofacteurs, par exemple."
Cependant, un défi restant est de concevoir l'inhibiteur de la déshydrogénase IMP d'une manière si spécifique qu'il bloque l'enzyme du parasite, mais pas l'enzyme humaine. Si cela réussit, la méthode pourrait potentiellement être étendue à d'autres agents pathogènes, explique Betzel. "D'autres parasites ont une structure très similaire, et il pourrait également être possible de les attaquer via la déshydrogénase IMP respective. L'enzyme est une cible très intéressante pour les médicaments, par exemple contre le ténia du renard ou l'agent pathogène de l'éléphantiasis."
Les universités de Hambourg, Lübeck et Tübingen, l'Académie des sciences de Russie, Université de l'État d'Arizona, le Lawrence Livermore National Laboratory aux USA, l'Institut Max Planck de recherche médicale, le US National Accelerator Laboratory SLAC, l'Université de Göteborg et DESY ont participé à cette recherche.