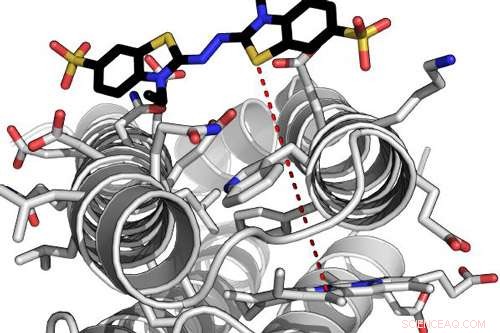
Modèle informatique d'une enzyme de novo hautement efficace interagissant avec l'un de ses substrats. La ligne en pointillé rouge indique la distance de tunnellisation des électrons entre la molécule d'hème liée à la protéine et le substrat lié. Crédit :Ross Anderson, Université de Bristol
Des scientifiques de l'Université de Bristol ont conçu une enzyme artificielle qui fonctionne aussi bien (et dans certains cas mieux que) une classe vitale d'enzymes naturelles.
Les enzymes sont des molécules biologiques fondamentalement importantes qui effectuent la majeure partie des réactions chimiques dans tous les organismes vivants.
Ces réactions alimentent la vie cellulaire et sont impliquées dans un grand nombre de processus nécessaires pour conférer aux cellules leurs caractéristiques chimiques et physiques.
Par ailleurs, de nombreuses enzymes participent à des réactions chimiques qui ont une valeur commerciale ou médicale, et pour lesquelles nous n'avons pas de bonnes substances synthétiques capables de catalyser de telles réactions avec la même précision et la même efficacité que les enzymes.
L'enzyme artificielle a été synthétisée sous une forme pleinement fonctionnelle par la bactérie E. coli et pourrait présenter un intérêt important pour l'industrie biotechnologique en raison de ses activités catalytiques pertinentes pour l'industrie, stabilité thermique et résistance chimique.
Elles pourraient même être utilisées en remplacement de certaines enzymes naturelles plus complexes et difficiles à produire à plus grande échelle.
Pour y parvenir, l'équipe a utilisé une approche qui élimine la complexité évolutive en utilisant de petits, protéines simples et complètement artificielles dans le processus de conception.
Dr Ross Anderson de l'École de biochimie de l'Université de Bristol, dit :« Nous décrivons ces protéines comme des maquettes, un terme utilisé en sculpture pour désigner un modèle à l'échelle à partir duquel une œuvre finale est créée.
"La maquette de protéine permet de même au concepteur d'incorporer des éléments fonctionnels sur un échafaudage de protéine stable. Dans ce cas, nous avons adapté une conception de maquette antérieure où nous avons utilisé la machinerie présente dans une cellule bactérienne vivante pour greffer de façon permanente la molécule d'hème dans la structure de la protéine. »
Les modifications apportées, facilité la liaison du peroxyde d'hydrogène à la molécule d'hème, une étape nécessaire de la catalyse commune à la famille des enzymes peroxydase.
Avec ces changements, la maquette était capable non seulement de lier le peroxyde d'hydrogène, mais aussi de le convertir en une forme plus réactive qui peut tirer des électrons d'une gamme de molécules organiques simples, de la même manière que les peroxydases naturelles fonctionnent.
Parce que la maquette est également entièrement assemblée en cellules bactériennes, il a permis à l'équipe d'exploiter ces transformations chimiques dans des cellules vivantes, ou envisager de l'intégrer dans les voies métaboliques d'un organisme.
Le Dr Anderson a ajouté :« Donc, en substance, nous avons fabriqué une enzyme artificielle (ou de novo) qui fonctionne aussi bien (et dans certains cas mieux qu') une classe vitale d'enzymes naturelles.
"C'est une promiscuité - comme le sont de nombreuses peroxydases naturelles - et pourrait constituer un prototype robuste à partir duquel de nombreux catalyseurs fonctionnels pourraient être développés.
« En activité catalytique, il est si proche des enzymes naturelles (et compte tenu du fait que les bactéries le fabriquent sous une forme active), si elle était purifiée sans connaître ses origines artificielles, on lui attribuerait une fonction naturelle et on la traiterait comme une nouvelle enzyme naturelle."