On pense que le vieillissement des populations et la tendance à mener une vie plus sédentaire dans de nombreuses régions du monde augmentent considérablement le nombre de personnes vivant avec de multiples maladies chroniques. De plus, le changement climatique, ainsi que l'évolution des modes d'utilisation des terres et de déplacement, continuent d'augmenter le risque de maladies infectieuses qui peuvent apparaître et se propager au niveau local et mondial.
Être capable de diagnostiquer rapidement la présence et l'évolution de toutes ces maladies pose un défi croissant aux systèmes de santé, un défi qui ne peut être relevé qu'à l'aide de tests de diagnostic efficaces au point d'intervention (POC), au-delà du cabinet du médecin et des soins médicaux avancés. installations.
Les tests POC ont apporté de nombreux avantages aux personnes pendant la pandémie de COVID-19, mais cette approche doit devenir applicable beaucoup plus largement et permettre aux médecins et aux patients d’approfondir les conditions pathologiques. Les technologies actuelles de diagnostic POC ne mesurent qu'un seul biomarqueur de maladie ou parfois plusieurs biomarqueurs appartenant à la même classe de molécules, tels que différents ARN, protéines ou anticorps.
Cependant, mesurer plusieurs biomarqueurs de différentes classes moléculaires pourrait fournir des informations plus complètes sur l'état dans lequel se trouve une maladie, sa gravité et sa progression au fil du temps, et même tenir compte des différences d'une personne à l'autre dans la façon dont elle se développe.
Les biocapteurs électrochimiques, qui convertissent un signal chimique sous la forme d'un biomarqueur présent dans un petit échantillon de biofluide, tel que le sang, la salive ou l'urine, en un signal électrique dont l'intensité correspond à la quantité détectée du biomarqueur, pourraient fournir le réponse à de nombreux problèmes de diagnostic POC.
En principe, plusieurs capteurs pour différentes molécules de biomarqueurs peuvent être combinés dans des réseaux de capteurs multiplexés et, plus important encore, la lutte contre le « biofouling », la destruction autrefois inévitable des surfaces des électrodes par des molécules biologiques non spécifiques contenues dans les échantillons, est devenue évitable grâce à l'ingénierie des les revêtements antifouling minces ont été mis au point à l'Institut Wyss de l'Université Harvard.
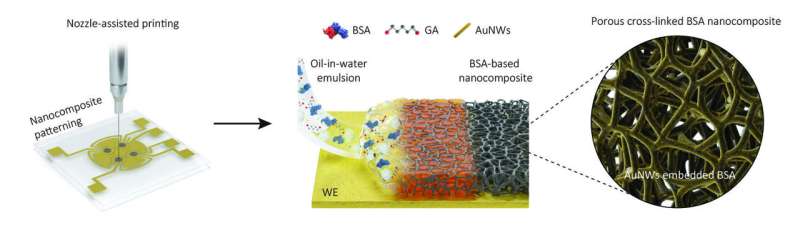
Aujourd'hui, l'équipe de recherche de l'Institut Wyss, en collaboration avec plusieurs instituts collaborateurs en Corée, a fait franchir une étape cruciale à la détection de diagnostic électrochimique vers une application plus large en développant un nouveau revêtement antisalissure poreux nanocomposite d'une épaisseur d'un micromètre, soit le diamètre de une bactérie, environ 100 fois plus épaisse que les revêtements précédents.
L'épaisseur accrue du revêtement et son réseau poreux ont permis l'incorporation d'un nombre beaucoup plus élevé de sondes de détection de biomarqueurs dans les capteurs, et ainsi, des sensibilités jusqu'à 17 fois plus élevées que les capteurs précédents, les meilleurs de leur catégorie, tout en offrant également des capacités antisalissure supérieures. .
Dans leur étude de validation de principe, les chercheurs ont construit des capteurs qui combinent la capacité de détecter des cibles de biomarqueurs d’acide nucléique, d’antigène et d’anticorps hôte spécifiques du COVID-19 dans des échantillons cliniques avec une sensibilité et une spécificité élevées. Leurs conclusions sont publiées dans Nature Communications. .
« Notre nouveau revêtement en émulsion poreuse épaisse s'attaque directement aux obstacles critiques qui empêchent actuellement l'utilisation généralisée de capteurs électrochimiques comme composants centraux de diagnostics POC complets pour de nombreuses conditions », a déclaré le dernier auteur et directeur fondateur de Wyss, Donald Ingber, M.D., Ph.D. .
"Cependant, au-delà de cela, cela pourrait également ouvrir de nouvelles opportunités pour développer des dispositifs implantables plus sûrs et plus fonctionnels et d'autres systèmes de surveillance des soins de santé sur plusieurs fronts de maladies. Surmonter les problèmes d'encrassement biologique et de sensibilité sont des défis qui ont un impact sur bon nombre de ces efforts." /P>
Ingber est également professeur Judah Folkman de biologie vasculaire à la Harvard Medical School et au Boston Children's Hospital et professeur Hansjörg Wyss d'ingénierie bioinspirée à la Harvard John A. Paulson School of Engineering and Applied Sciences.
En 2019, le projet de capteur électrochimique du Wyss Institute a publié son premier article historique faisant état du premier revêtement antisalissure doté de capacités de biodétection sans précédent.
Dans une série d'études de suivi critiques, l'équipe a accru le potentiel de la détection électrochimique en faisant progresser la nanochimie des revêtements pour rendre les électrodes encore plus sensibles aux biomarqueurs, en ajoutant d'importantes capacités de multiplexage et en développant des méthodes de fabrication réduisant les coûts.
Les biocapteurs les plus avancés que l'équipe a conçus sur la plateforme eRapid de Wyss disposaient d'un ensemble de fonctionnalités qui permettent déjà leur application dans certains contextes cliniques.
Cependant, la méthode de revêtement utilisée par l'équipe a exposé l'intégralité de la puce du capteur à la solution nanocomposite et n'a permis qu'à un revêtement relativement mince d'environ 10 nanomètres de se former sur toute la surface du capteur, ce qui a limité la fonctionnalité des capteurs de plusieurs manières.
Par exemple, le diamètre fin du revêtement limitait la quantité maximale de sonde pouvant y être chargée, ce qui devient particulièrement critique dans les capteurs multiplexés de plus grande taille qui doivent encore fonctionner avec de petits volumes d'échantillons et encore plus dans les efforts visant à miniaturiser les capteurs multiplexés pour leur utilisation. dans les appareils de diagnostic portables POC.
"Dans cette nouvelle étude, nous avons trouvé une toute nouvelle solution à ce problème, qui a abouti à un revêtement 100 fois plus épais. Notre nouvelle approche exploite une méthode d'impression à jet d'encre qui nous permet d'appliquer ce revêtement épais très localement sur un capteur individuel. ", a déclaré Pawan Jolly, Ph.D., ancien scientifique principal de Wyss, qui a joué un rôle déterminant dans l'évolution de la plateforme eRapid.
"Cela ouvre de nouvelles possibilités :premièrement, nous pouvons inclure des quantités beaucoup plus élevées de sondes de détection de biomarqueurs dans le revêtement et, à l'avenir, les capteurs des réseaux complexes pourront être adressés individuellement en leur appliquant des produits chimiques nanocomposites spécifiquement adaptés à des applications spécifiques. modalités des biomarqueurs."
Au lieu de plonger littéralement les électrodes électrochimiques dans une solution de revêtement, comme ils le faisaient pour leur génération précédente de capteurs, les chercheurs ont imprimé une couche d'une émulsion dense d'huile dans l'eau à travers une fine buse sur les électrodes. Après évaporation des minuscules bulles d'huile, un revêtement d'un micromètre d'épaisseur est resté sur la surface de l'électrode, constitué de molécules polymères réticulées de l'albumine protéique du sang et contenant des pores interconnectés et des nanofils d'or conducteurs d'électrons.
"Le réseau poreux de ce revêtement nanocomposite augmente considérablement la surface qui peut être utilisée pour fixer des sondes de détection de biomarqueurs spécialement conçues, et qui est en même temps accessible aux échantillons de fluides. En conséquence, la sensibilité de détection est considérablement augmentée." a expliqué le premier auteur, Jeong-Chan Lee, Ph.D., chercheur postdoctoral dans l'équipe d'Ingber.
"De plus, l'impression par buse nous permet de modeler l'émulsion exclusivement sur l'électrode de travail de détection du biomarqueur tout en gardant l'électrode de référence voisine contenue dans chaque capteur libre, ce qui réduit le bruit électrique non spécifique et améliore la spécificité de nos mesures."
L'équipe a réutilisé une combinaison précédemment développée de réactifs de détection pour trois biomarqueurs liés au COVID-19 afin de modéliser un réseau d'électrodes de capteur à l'aide de leur technologie de revêtement nouvellement développée :un capteur compatible CRISPR pour un ARN du SRAS-CoV-2, un capteur spécifique pour un antigène de capside du SRAS-CoV-2 et un capteur pour un anticorps hôte dirigé contre le virus.
Testé avec une collection d'échantillons de patients, le nouveau capteur a produit des sensibilités de détection améliorées de 3,75 à 17 fois par rapport à un précédent fabriqué avec les mêmes systèmes de détection et le meilleur revêtement non poreux et beaucoup plus fin de l'équipe. Il a également distingué les échantillons positifs des échantillons négatifs avec une précision de 100 % (spécificité).
"Les capteurs électrochimiques dotés de ce revêtement de nouvelle génération seraient idéaux pour surveiller les épidémies virales, les réponses vaccinales et comprendre les corrélations entre divers biomarqueurs au cours des infections virales et, à l'avenir, ils pourraient également être utilisés pour d'autres maladies." dit Lee.
Plus d'informations : Jeong-Chan Lee et al, Revêtement nanocomposite micrométrique et poreux pour capteurs électrochimiques doté de propriétés antifouling et électroconductrices exceptionnelles, Nature Communications (2024). DOI : 10.1038/s41467-024-44822-1
Informations sur le journal : Communications naturelles
Fourni par l'Université Harvard