Dans une nouvelle Communications Nature Dans cette étude, les chercheurs ont exploré la construction de circuits génétiques sur des molécules d'ADN uniques, démontrant la synthèse localisée de protéines comme principe directeur pour les nanodispositifs dissipatifs, offrant ainsi un aperçu de la conception de cellules artificielles et des applications de la nanobiotechnologie.
Le terme « circuit génétique » est une description métaphorique du réseau complexe d'éléments génétiques (tels que des gènes, des promoteurs et des protéines régulatrices) au sein d'une cellule qui interagissent pour contrôler l'expression des gènes et les fonctions cellulaires.
Dans le domaine de la conception de cellules artificielles, les scientifiques visent à reproduire et à concevoir ces circuits génétiques pour créer des unités fonctionnelles et autonomes. Ces circuits agissent comme une machinerie moléculaire chargée d'orchestrer les processus cellulaires en régulant avec précision la production de protéines et d'autres molécules.
En comprenant et en manipulant ces circuits, les chercheurs peuvent concevoir des cellules artificielles dotées de comportements programmables, imitant les fonctionnalités des cellules naturelles.
Dans le cadre de l’étude mentionnée, l’accent est mis sur la construction de circuits génétiques sur des molécules d’ADN uniques. Il s'agit d'une approche nouvelle car elle s'éloigne du contexte cellulaire traditionnel et explore la possibilité de créer des circuits génétiques dans des conditions acellulaires.
Le premier auteur, le Dr Ferdinand Greiss de l'Institut Weizmann des Sciences en Israël, a expliqué la motivation des chercheurs à Phys.org :« Nous essayons de reconstituer les processus biologiques en dehors des circuits complexes des cellules vivantes, en améliorant, espérons-le, notre compréhension des principes directeurs de la nature. la recherche est orientée vers la construction de futures cellules artificielles, et des molécules d'ADN uniques pourraient en être le fondement génétique. "
La régulation génique est le processus par lequel les cellules contrôlent l'expression des gènes, déterminant quand et dans quelle mesure les informations d'un gène sont utilisées dans la synthèse de molécules fonctionnelles comme les protéines ou l'ARN. Il joue un rôle crucial dans le maintien des fonctions cellulaires, la réponse aux changements environnementaux et le bon développement.
La régulation de l'expression des gènes implique la transcription et la traduction. Lors de la transcription, un segment spécifique d'ADN sert de modèle pour la synthèse de molécules d'ARNm complémentaires par l'ARN polymérase. Cet ARNm transporte le code génétique du noyau au cytoplasme, où se produit la traduction.
La traduction implique la conversion de l'ARNm en protéines. Les ribosomes lisent la séquence d'ARNm, facilitant l'assemblage des acides aminés dans une chaîne polypeptidique, formant la protéine codée par le gène.
"Dans les systèmes procaryotes, les processus de transcription et de traduction sont couplés. Cela signifie qu'une fois que l'ARN polymérase produit l'ARNm à partir de l'ADN, le ribosome peut trouver le site de liaison ribosomique sur l'ARNm naissant pour commencer à synthétiser la protéine. La protéine naissante peut se replier et fonctionner. alors qu'elle est encore attachée à l'ADN par le complexe ARN polymérase-ARNm-ribosome, après la fin de la transcription ou de la traduction, la protéine naissante se détache de l'ADN et se disperse dans la solution globale », a expliqué la co-auteure Shirley Shulman Daube de l'étude. Institut des sciences Weizmann en Israël.
L'importance réside dans l'augmentation de la concentration locale de protéines naissantes, qui est environ 1 000 fois supérieure à celle de la solution globale environnante. Cette organisation spatiale et cette augmentation de la concentration pourraient avoir des implications sur les fonctions cellulaires et potentiellement jouer un rôle dans la construction de cellules artificielles utilisant des molécules d'ADN uniques.
"Les circuits génétiques sont basés sur des molécules génétiquement codées, telles que des facteurs de transcription, qui sont produites à partir de l'ADN et se lient à l'ADN pour réguler leur propre production et celle d'autres molécules", a déclaré le co-auteur, le Dr Vincent Noireaux de l'Université du Minnesota. .
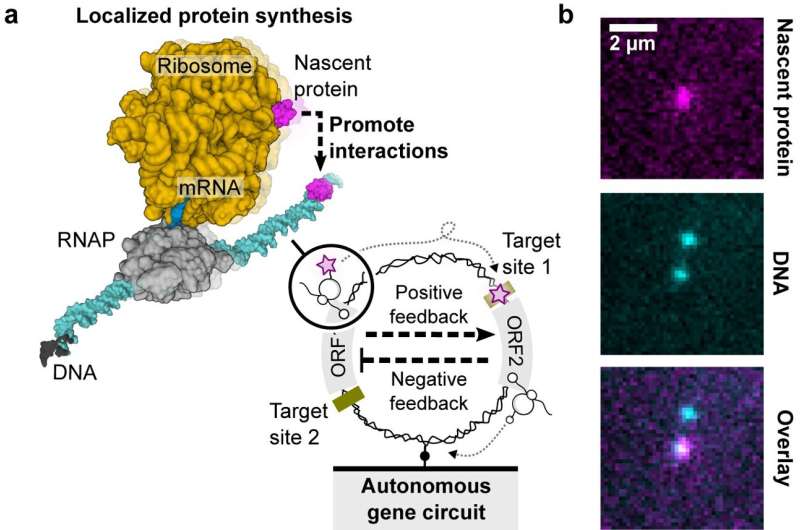
Pour construire le circuit génétique sur une seule molécule d'ADN, les chercheurs ont conçu des séquences spécifiques avec les gènes du bactériophage lambda (E. coli).
Le circuit génétique impliquait une cascade négative, guidée par le gène répresseur CI et son site de liaison opérateur, contrôlant de manière complexe le gène HT. Ce gène HT codait pour la protéine HaloTag (HT), un élément crucial pour visualiser les protéines naissantes sur des molécules d'ADN individuelles.
L'étude a mis en œuvre des conditions strictes, notamment une faible densité de surface d'ADN, pour garantir une synthèse protéique localisée précise.
Simultanément, une cascade positive s'est déroulée avec la fusion de l'ARN polymérase du bactériophage T7 (HT-T7 RNAP) et de la protéine HT, permettant la surveillance en temps réel de l'expression des gènes via un gène rapporteur en aval, GFP.
Un colorant fluorogène rouge lointain (MaP655-Halo) a amélioré la détection des protéines naissantes, offrant ainsi une vue complète de la dynamique du circuit génétique.
La cascade négative, ou suppression, régule et inhibe la production de protéines spécifiques dans certaines conditions. D'un autre côté, les cascades positives contribuent à l'activation et à l'expression de gènes spécifiques au sein du circuit génétique.
La recherche est allée au-delà de la simple observation, en intégrant un circuit de rétroaction doté d'un répresseur synthétique dCro. Ce composant était crucial dans la régulation de l'expression des gènes grâce à un promoteur synthétique méticuleusement conçu.
Les chercheurs ont découvert que la synthèse localisée de protéines sur une seule molécule d’ADN peut piloter des circuits génétiques dans des conditions acellulaires, sans confinement des compartiments cellulaires. La dynamique des circuits génétiques a été méticuleusement observée dans des conditions très diluées.
L'auteur principal, le Dr Roy Bar-Ziv de l'Institut Weizmann des Sciences en Israël, a souligné l'importance de leurs découvertes :« La régulation de l'expression des gènes dépend de la liaison des protéines à l'ADN, bloquant ou augmentant l'activité d'un gène. "
Essentiellement, cette découverte remet en question la notion conventionnelle selon laquelle des concentrations élevées sont essentielles à la régulation des gènes, en introduisant un nouvel aspect de la synthèse protéique localisée comme moyen d'influencer les circuits génétiques dans des conditions acellulaires.
Pour les travaux futurs, les chercheurs envisagent d’exploiter la synthèse protéique localisée comme principe directeur pour améliorer la fonctionnalité des cellules artificielles construites à partir de molécules d’ADN uniques, en relevant les défis à faibles concentrations. Ils prévoient également des applications potentielles dans les nanodispositifs autocodés et prévoient d'explorer les corrélations entre la structure de l'ADN, la dynamique de l'expression des gènes et la synthèse des protéines.
La recherche a également impliqué les contributions de Nicolas Lardon et du professeur Kai Johnsson du MPI pour la recherche médicale, qui ont développé le colorant fluorogénique (MaP655-Halo) ; Yoav Barak, qui a contribué à l'optimisation de la préparation de l'ADN ; et Leonie Schütz avec le professeur Elmar Weinhold, pionnier du développement de méthyltransférases pour les modifications de l'ADN spécifiques à un site avec des biotines.
Plus d'informations : Ferdinand Greiss et al, Un circuit génétique sur une seule molécule d'ADN en tant que nanodispositif dissipatif autonome, Nature Communications (2024). DOI :10.1038/s41467-024-45186-2
Informations sur le journal : Communications naturelles
© 2024 Réseau Science X