Dans une étude récemment publiée dans la revue Small , des chercheurs du Nano Life Science Institute (WPI NanoLSI), de l'Université de Kanazawa, au Japon, en collaboration avec le professeur Sarikaya, à Seattle, aux États-Unis, ont utilisé la microscopie à force atomique à modulation de fréquence pour révéler l'architecture moléculaire de peptides génétiquement conçus et mutés ponctuellement ainsi que leurs auto-organisations. formant des cristaux biologiques épais et distincts d'une seule molécule sur du graphite atomiquement plat et du MoS2 surfaces, offrant une plate-forme potentielle pour les technologies hybrides telles que la bioélectronique, les biocapteurs et les réseaux de protéines.
Les protéines sont les éléments de base moléculaires clés de la biologie, remplissant des fonctions enzymatiques, transportant des ions et des électrons et constituant l’infrastructure majeure des architectures cellulaires, telles que les pompes à ions. Les fonctions des protéines dépendent de leurs séquences d'acides aminés, qui, à leur tour, dictent leurs structures moléculaires tridimensionnelles.
Les séquences d'acides aminés des protéines sont codées par les gènes (code ADN) d'une cellule spécialisée donnée. Tout défaut dans la séquence d'acides aminés, tel qu'une mutation ponctuelle, un changement d'emplacement d'un acide aminé, un acide aminé manquant ou la transposition de deux ou plusieurs acides aminés, devrait donc affecter la structure moléculaire de la protéine. , ce qui se reflète dans leur fonction, conduisant souvent à des maladies génétiques.
Semblables aux protéines, les peptides sont également composés d’unités d’acides aminés et chaque peptide possède une séquence unique ; cependant, ils sont beaucoup plus courts, allant de 10 à 30 unités, et codés de la même manière par l’ADN. Elles sont plus faciles à manipuler, à concevoir et à utiliser que les protéines, qui sont beaucoup plus grosses (des centaines ou des milliers d'acides aminés de long), difficiles à synthétiser et peu pratiques à utiliser.
Par conséquent, il est impératif que si la technologie pratique du futur doit être développée sur la base des enseignements de la biologie à l’échelle moléculaire, la science fondamentale doit être établie à l’aide de peptides, qui pourront ensuite être mis en œuvre dans des applications réelles, telles que les biocapteurs. , la bioélectronique et les dispositifs logiques, ainsi que les médicaments, tous basés sur les leçons de la biologie.
Conscient de ce principe, le professeur Sarikaya a lancé il y a vingt ans une nouvelle approche scientifique de convergence, impliquant le génie génétique, la biologie moléculaire, l'informatique, l'apprentissage automatique ainsi que la science et l'ingénierie des matériaux, dans la conception de peptides à liaison solide, et a démontré leur utilisation dans des technologies hybrides pratiques. /P>
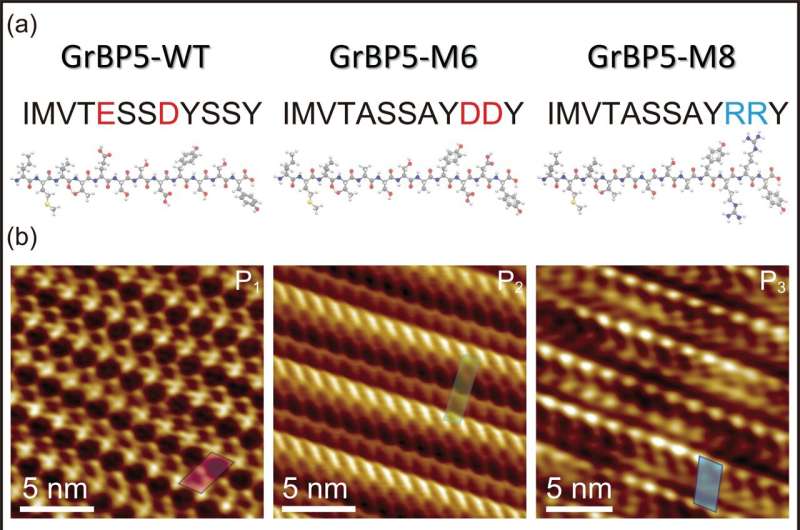
Dans cette nouvelle étude, l'un de ces peptides, spécifiquement conçu comme un peptide liant le graphite, est muté en deux peptides différents, M6 et M8, chacun ayant nominalement le même poids moléculaire et la même taille mais contenant des mutations ponctuelles des acides aminés chargés, un négatif et l'autre positif, respectivement.
Comme prévu, ils fonctionneraient différemment, ce qui fut le cas. Cependant, la question impossible à prédire a priori était de savoir comment exactement ils agiraient différemment les uns des autres et du peptide de type sauvage (l'original), et quels seraient les détails de leur structure moléculaire et de leur comportement cinétique à la surface du peptide. substrat graphite.
Les réponses à ces questions, dont l'absence limitait jusqu'à présent la compréhension de la relation entre les mutants et leur comportement prévisible, nécessitaient une très haute résolution et une imagerie directe des molécules dans leur état natif, dans l'eau sur une période de quelques secondes à quelques heures. /P>
C'est là qu'intervient le laboratoire du professeur Takeshi Fukuma au WPI Nano Life Science Institute de l'université de Kanazawa, où son équipe a développé des installations de microscopie à force atomique à modulation de fréquence capables d'interroger des objets à l'échelle moléculaire avec une résolution d'image proche de l'angström et pour de longues périodes de temps dans des environnements aqueux :une combinaison inhabituelle de capacités pour un système expérimental, en particulier pour la recherche biologique.
Grâce aux capacités expérimentales très compétentes des chercheurs (avec une patience inépuisable dans des tests de longue durée), dirigés par le Dr Ayhan Yurtsever, le Dr Kaito Hirata, le Dr Linhao Sun et le Dr Takeshi Fukuma, l'équipe a découvert le comportement du mutants avec des détails sans précédent, fournissant des résultats d'une signification qui traverse plusieurs disciplines traditionnellement diverses, de la science des matériaux à la physique, en passant par la chimie et la biologie.
Premièrement, malgré les mutations et ayant individuellement une charge globale différente, chaque peptide non seulement s’est lié à la surface du graphite, mais s’est également assemblé, formant des cristaux peptidiques d’une seule molécule. Cependant, alors que le premier mutant, celui chargé négativement, formait un réseau oblique cristallin avec deux molécules (enroulées l'une autour de l'autre) dans chaque réseau, le deuxième mutant, celui chargé positivement, formait un réseau oblique différent contenant un seul peptide. /P>
Ce qui est vraiment intéressant ici, c'est que le comportement des peptides est simplement et directement lié à leur architecture moléculaire, modélisée par la dynamique moléculaire. Les chercheurs ont donc pu décrire mathématiquement la relation entre chacun des peptides (chacun formant un réseau moléculaire oblique différent) et le réseau hexagonal du substrat de graphite, qui est exclusivement décrit comme une reconnaissance chirale.
En effet, cela signifie qu'il est démontré que chaque peptide forme une interface hybride avec le substrat graphite, mieux décrite comme étant cristallographiquement cohérente sans écart notable entre les deux, un peu comme les interactions ligand-récepteur ou protéine/ADN en biologie.
Ni la reconnaissance moléculaire d'objets à l'état solide par une molécule « vivante » n'a été aussi clairement observée auparavant, ni ses détails n'ont été décrits comme chiraux, ce qui ajoute à l'importance des résultats présentés dans cette publication.
D'une part, du point de vue de la biologie, il existe désormais de nombreuses données et détails sur la façon dont les mutations conduisent à des changements de conformation moléculaire et sur la fonction des peptides qui en résultent, qui peuvent être étendus au comportement des protéines, avec une importance dans les mutations génétiques et l'efficacité. conception de médicaments.
D'un autre côté, l'hybridation cohérente suggère que les objets nanométriques animés et inanimés sont présents de manière stable au niveau de la même interface souple, formant un pont moléculaire exclusif qui pourrait être mieux décrit en intégrant de manière transparente la biologie avec des dispositifs à l'état solide.
Si tel est le cas, sur la base de cette étude, les scientifiques et les technologues devraient élargir considérablement le répertoire de la base moléculaire des futurs bio/nano dispositifs en utilisant le simple outil de biologie moléculaire qu'est la mutation.
Plus d'informations : Ayhan Yurtsever et al, Dynamique de l'auto-assemblage moléculaire de peptides courts aux interfaces liquide-solide - Effet des mutations ponctuelles d'acides aminés chargés, Petit (2024). DOI : 10.1002/smll.202400653
Informations sur le journal : Petit
Fourni par l'Université de Kanazawa