Les anévrismes de l'aorte sont des renflements de l'aorte, le plus gros vaisseau sanguin qui transporte le sang riche en oxygène du cœur vers le reste du corps. Le tabagisme, l'hypertension artérielle, le diabète ou les blessures peuvent tous augmenter le risque d'anévrismes, qui ont tendance à survenir plus souvent chez les fumeurs de race blanche de plus de 65 ans.
"Les tissus mous qui composent les vaisseaux sanguins agissent essentiellement comme des élastiques, et ce sont les fibres élastiques de ces tissus qui leur permettent de s'étirer et de se replier", explique le professeur Anand Ramamurthi, directeur du département de bio-ingénierie du P.C. de l'université de Lehigh. Collège Rossin d'ingénierie et de sciences appliquées.
"Ces fibres sont produites principalement avant et juste après la naissance. Après cela, elles ne se régénèrent pas et ne subissent pas de réparation naturelle après une blessure. Ainsi, lorsqu'elles sont blessées ou malades, le tissu s'affaiblit et provoque un anévrisme, qui peut se développer avec le temps. environ sept à dix ans, il atteint généralement le stade de la rupture."
Pendant cette période, il n’y a aucun traitement. Les patients sont examinés régulièrement par imagerie pour surveiller le taux de croissance de l'anévrisme. Une fois qu'il est jugé suffisamment gros pour potentiellement se rompre (un événement mortel dans 90 % des cas), la chirurgie est la seule option. Mais c'est risqué pour les patients âgés.
Ramamurthi et son équipe travaillent sur des moyens peu invasifs pour régénérer et réparer ces fibres élastiques à l'aide de nanocapsules polymères ou biologiques, appelées nanoparticules, conçues pour libérer de nouvelles thérapies régénératives. Leurs techniques innovantes pourraient permettre un traitement peu de temps après la détection d'un anévrisme et potentiellement ralentir, inverser ou même arrêter sa croissance.
Résultats de leur article le plus récent, publié dans le Journal of Biomedical Materials Research Part A , s'appuient sur leurs travaux antérieurs et représentent une étape vers un avenir où la chirurgie n'est plus la meilleure et la seule option de traitement.
"Dans des recherches antérieures, nous avons identifié des médicaments et des agents de silençage génétique qui peuvent réellement inciter les cellules vasculaires malades adultes à produire de nouvelles fibres élastiques et à inhiber les enzymes qui décomposent les fibres existantes", explique-t-il. "Nous avons également travaillé sur la façon d'administrer efficacement ces produits thérapeutiques uniquement sur le site de réparation des tissus."
L'équipe a également développé une conception de nanoparticules appelée ciblage actif qui incorpore de petits fragments de protéines, ou peptides, à la surface des nanoparticules. "Ces peptides reconnaissent des composants uniques au tissu de l'anévrisme. Ainsi, lorsque les nanoparticules sont injectées dans la circulation sanguine, elles adhèrent uniquement à la paroi de l'anévrisme, où elles se dégradent lentement et libèrent le médicament.
Pour cet article, dit-il, les chercheurs "ont étudié comment les nanoparticules pénètrent réellement dans la paroi des vaisseaux sanguins pour délivrer le médicament aux tissus affectés".
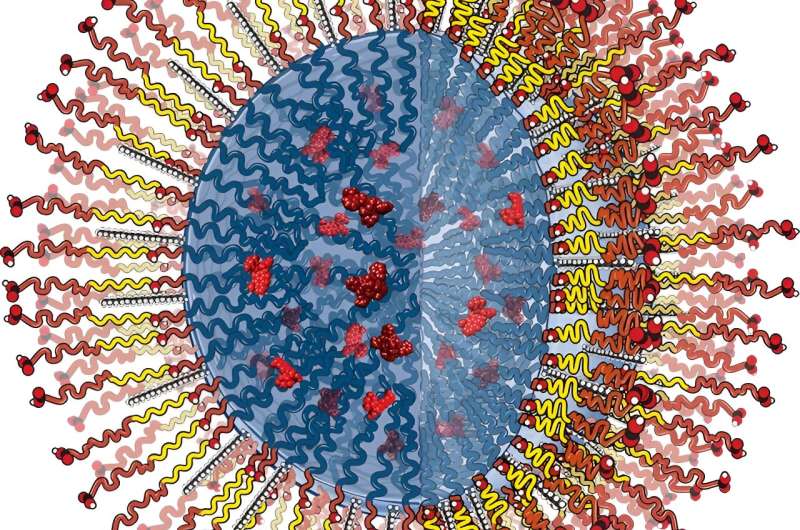
Tous les vaisseaux sanguins sont tapissés d'une barrière protectrice constituée de cellules endothéliales, qui peuvent devenir « perméables » à mesure que l'inflammation causée par des lésions tissulaires ou une maladie détruit l'endothélium et crée des espaces entre les cellules. Ces lacunes permettent aux globules blancs d'entrer et de démarrer le processus de réparation des tissus, et servent également de point d'entrée aux nanoparticules qui accélèrent la guérison.
"Nous voulions savoir comment la forme et le rapport hauteur/largeur de ces nanoparticules affectent leur capacité à traverser cette barrière cellulaire endothéliale", explique Ramamurthi.
Il était crucial de répondre à cette question, car toutes les nanoparticules ne sont pas créées de la même façon, et si elles ne peuvent pas pénétrer la barrière, elles ne peuvent pas réparer les tissus.
Ramamurthi et son équipe ont développé un nouveau modèle de culture cellulaire dans lequel ils ont simulé une maladie, puis examiné les mécanismes de transport, en particulier la façon dont les nanoparticules de différents types interagissaient avec les cellules endothéliales et se déplaçaient à travers elles. Sont-ils entrés par des interstices entre les cellules endothéliales (un processus appelé extravasation) ou par les cellules elles-mêmes (ce qu'on appelle une translocation) ?
"Disons qu'une nanoparticule traverse une cellule endothéliale. Une partie peut rester dans cette cellule et ne pas sortir de l'autre côté, ce qui signifie que vous perdez cette particule et qu'elle n'est plus utile au processus de guérison. L'objectif est un transport avec un minimum de moyens. rétention."
L’équipe a découvert que les particules en forme de bâtonnet, par opposition aux particules sphériques, avec un rapport d’aspect élevé (c’est-à-dire longues et fines contre courtes et trapues) étaient sélectivement absorbées par les cellules endothéliales malades. "Et ils ont montré très peu d'absorption dans les cellules endothéliales saines par rapport aux sphères, ce qui est une bonne chose car nous ne voulons pas qu'elles interagissent avec les parois des vaisseaux sains", dit-il.
Ils ont également constaté que les particules atteignaient les tissus principalement par extravasation (ou via les interstices cellulaires). "Plus ils étaient longs et maigres, moins ils étaient susceptibles de rester dans la couche de cellules endothéliales, ce qui signifie qu'ils parviennent jusqu'aux tissus affectés pour une thérapie plus efficace."
L'équipe va désormais intégrer ces découvertes à ses travaux sur le ciblage actif, intégrant des composants à la surface des nanoparticules qui reconnaissent les protéines exprimées par les cellules malades, dans des modèles animaux.
Le but ultime est de développer une thérapie régénérative non chirurgicale capable de ralentir la croissance des anévrismes. Par exemple, augmenter la phase actuelle de croissance jusqu’à la rupture de sept ans à 15 ans. Un résultat encore plus ambitieux, dit Ramamurthi, serait d'inverser cette croissance.
"La régression de la croissance de l'anévrisme serait le résultat privilégié à long terme", dit-il. "C'est encore loin, mais nous sommes ravis car ces résultats nous aideront à concevoir nos nanoparticules pour une administration plus efficace à la paroi de l'anévrisme. C'est une opportunité de nous rapprocher de cette réalité."
Plus d'informations : Jimmy Yau et al, Évaluation du transport transendothélial de nanoparticules pour leur administration dans les anévrismes de l'aorte abdominale, Journal of Biomedical Materials Research Part A (2024). DOI : 10.1002/jbm.a.37667
Fourni par l'Université de Lehigh