Le Dr Petr Cígler et ses collaborateurs travaillent à perfectionner les systèmes moléculaires permettant de transporter les molécules d'acide ribonucléique (ARN) dans les cellules. La question de savoir comment délivrer efficacement l'ARN à un endroit désigné du corps afin de faire taire un gène défectueux est l'un des plus grands défis du domaine en développement rapide de la médecine génique.
Aujourd'hui, des chercheurs de l'Institut de chimie organique et de biochimie de l'Académie tchèque des sciences (IOCB Prague) ont franchi une nouvelle étape importante vers la réalisation de cet objectif. Ils ont décrit en détail la préparation d’un nouveau nanomatériau vecteur composite pour le transport de l’ARN, dans lequel ils se sont principalement attachés à garantir sa non-toxicité pour les cellules. La raison en est que la nocivité des vecteurs d'acide nucléique connus jusqu'à présent constitue un obstacle sérieux à l'expansion de la thérapie génique.
Un article sur le sujet a été publié dans Advanced Functional Materials. .
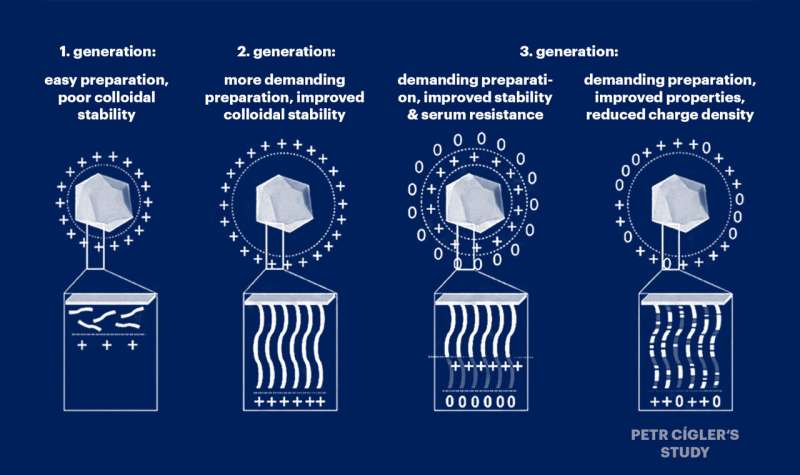
Petr Cígler et ses collègues partaient de l'hypothèse que la toxicité des vecteurs d'acide nucléique était causée par une accumulation excessive de charges positives le long des chaînes de polymères porteurs qui lient les acides nucléiques. Par conséquent, ils ont systématiquement dilué cette charge positive avec des monomères non chargés et ont constaté que sa légère dilution ne nuisait pas à la capacité du système à transporter les acides nucléiques.
Dans leur étude approfondie, ils décrivent également les circonstances dans lesquelles de nouveaux matériaux peuvent être préparés pour être utilisés en médecine génétique. Les chercheurs ont prêté une attention particulière aux conditions dans lesquelles ces substances se lient le plus efficacement aux acides nucléiques et dans quelle proportion stoechiométrique.
Les cellules peuvent réguler la traduction des gènes de l’ARNm aux protéines de plusieurs manières. L’une d’elles consiste à faire taire un gène à l’aide d’une molécule de siRNA (petit ARN interférent). Cela bloque la production de la protéine cible, ce qui est particulièrement utile si le gène codant est muté ou autrement défectueux. De plus, il est possible d'intervenir si les mécanismes innés de régulation de la traduction sont altérés. Dans un tel cas, l'organisme produit trop de protéines, ce qui nuit à sa santé.
"La thérapie génique est non seulement très efficace, mais elle est également extrêmement ciblée. Son plus grand avantage réside dans le fait qu'elle cible avec précision des mutations ou des troubles individuels sans risquer de rater la cible. Grâce à l'ARNsi, il est possible de toucher ne serait-ce qu'un seul muté. " lettre d'un gène", explique Marek Kindermann, premier auteur de l'étude, énumérant les principaux avantages de la thérapie génique. Actuellement, cinq médicaments à base d'ARNsi sont approuvés pour une utilisation mondiale, et il y en a environ une douzaine d'autres sur la « liste d'attente ».
L’utilisation thérapeutique des siARN est entravée par le fait que les molécules de siARN sont instables et se décomposent donc très rapidement dans l’organisme. Les experts du monde entier s'attaquent donc au problème de savoir comment acheminer le siARN vers un endroit désigné et lui permettre de faire son travail, qui consiste à arrêter ou à limiter la production d'une certaine protéine indésirable en faisant taire le gène correspondant.
Cette tâche a également été entreprise par l'équipe de Petr Cígler de l'IOCB Prague, en collaboration avec des collègues de l'Institut de microbiologie de l'Académie tchèque des sciences, dirigés par la chef du groupe de nanomédecine, le Dr Veronika Benson.
"Chaque système de transport est conçu pour répondre à deux objectifs fondamentaux :tout d'abord, il a pour tâche de protéger la molécule de la décomposition, et deuxièmement, il doit assurer son transport dans la cellule pour qu'elle atteigne le cytosol et remplisse sa mission de transporteur. drogue là-bas", explique Petr Cígler.
"Dans notre étude, nous traitons en détail des propriétés du système de transport. Nous descendons jusqu'au niveau des détails structurels des molécules qui interagissent avec les acides nucléiques. Nous décrivons les conditions nécessaires pour que le siARN se lie avec succès au nanosystème de transport puis atteindre l'espace intracellulaire. "
Les chercheurs de l'IOCB Prague ouvrent ainsi la voie à l'utilisation de particules appelées vecteurs non viraux, qui n'utilisent pas de virus pour transporter l'ARN. Ils ont placé l’ensemble du système de transport, y compris l’acide nucléique, à la surface des nanoparticules de diamant. Il s'agit de particules porteuses particulièrement stables, qui émettent également un type particulier de fluorescence. Cela permet de suivre leur parcours à travers les tissus et de surveiller leur comportement à l'intérieur des cellules.
Une complication est qu'il est difficile pour le corps de se débarrasser des nanodiamants, cette méthode de thérapie génique convient donc principalement au traitement des plaies superficielles difficiles à cicatriser. C'est à ces types de thérapie, axés sur la guérison des ulcères de jambe chez les patients diabétiques, que sont destinés les nouveaux nanomatériaux de transport, présentés dans ce travail et dans d'autres de l'équipe du Dr Cígler et de ses collaborateurs.
Leur dernière étude approfondie a également été rendue possible grâce au projet AMULET, qui se concentre sur le développement de nanomatériaux multi-échelles et rassemble huit partenaires dirigés par l'Institut Jaroslav Heyrovský de chimie physique.
Plus d'informations : Marek Kindermann et al, Règles de conception pour l'interface nano-bio des nanodiamants :implications pour la vectorisation des siARN, Matériaux fonctionnels avancés (2024). DOI : 10.1002/adfm.202314088
Informations sur le journal : Matériaux fonctionnels avancés
Fourni par l'Institut de chimie organique et de biochimie du CAS