Des chercheurs de TUS ont développé une nanoparticule comestible à base de plantes qui pourrait être la prochaine thérapie anticancéreuse puissante. Crédit :Makiya Nishikawa de l'Université des sciences de Tokyo
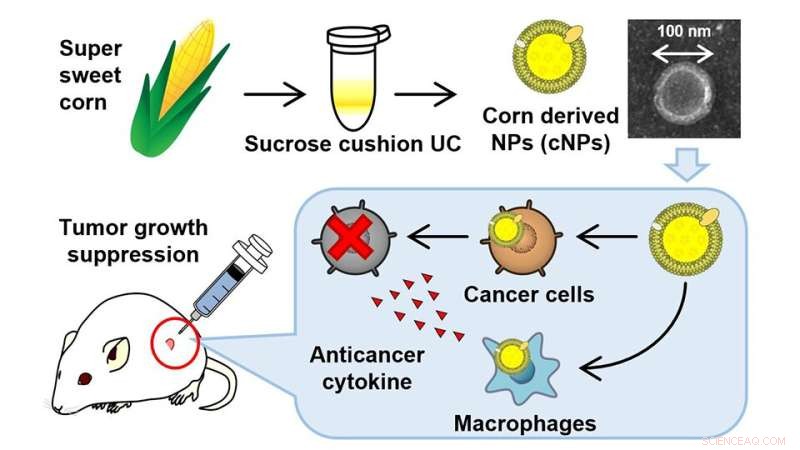
Les nanomatériaux ont révolutionné le monde de la thérapie contre le cancer, et les nanoparticules d'origine végétale ont l'avantage supplémentaire d'être rentables et faciles à produire en masse. Des chercheurs de l'Université des sciences de Tokyo ont récemment développé de nouvelles bionanoparticules dérivées du maïs pour cibler directement les cellules cancéreuses, via un mécanisme immunitaire. Les résultats sont encourageants et la technique a démontré son efficacité dans le traitement des souris de laboratoire porteuses de tumeurs. De plus, aucun effet indésirable grave n'a été signalé chez la souris jusqu'à présent.
Les nanoparticules, ou particules dont la taille varie entre 1 et 100 nanomètres, ont montré un énorme potentiel dans de nombreux domaines de la science et de la technologie, y compris la thérapeutique. Cependant, les nanoparticules synthétiques conventionnelles sont compliquées et coûteuses à produire. Les vésicules extracellulaires (EV), qui sont apparues comme une alternative aux nanoparticules synthétiques, présentent des défis pour la production de masse.
Une autre option récemment apparue est celle des nanoparticules (NP) dérivées de plantes, qui peuvent être facilement produites à des niveaux élevés à des coûts relativement inférieurs. Comme les véhicules électriques, ces systèmes à base de nanoparticules contiennent également des molécules bioactives, notamment des polyphénols (qui sont des antioxydants connus) et des microARN, et ils peuvent délivrer des médicaments aux organes cibles de notre corps.
Tirant parti de ces connaissances, des chercheurs de l'Université des sciences de Tokyo (TUS) ont récemment développé des bionanoparticules à activité anticancéreuse, en utilisant le maïs (maïs) comme matière première.
Le professeur Makiya Nishikawa de l'Université des sciences de Tokyo, au Japon, qui a dirigé l'équipe de recherche dans cette entreprise, explique :"En contrôlant les propriétés physicochimiques des nanoparticules, nous pouvons contrôler leur pharmacocinétique dans le corps ; nous voulions donc explorer la nanoparticulation de comestibles. Le maïs, ou maïs, est produit en grande quantité dans le monde entier sous sa forme native ainsi que sous ses formes génétiquement modifiées. C'est pourquoi nous l'avons sélectionné pour notre étude. Les résultats de cette étude ont été publiés en ligne le 24 novembre 2021 dans Scientific Reports .
L'équipe a créé un mélange homogène de maïs super doux dans de l'eau, puis a centrifugé ce jus de maïs à grande vitesse, puis l'a filtré à travers un filtre à seringue avec une taille de pores de 0,45 μm. Les échantillons filtrés ont ensuite été ultracentrifugés pour obtenir des NP dérivées du maïs. Les NP dérivées du maïs (cNP) mesuraient environ 80 nm de diamètre. Fait intéressant, ces cNP portaient également une minuscule charge négative nette de -17 mV.
L'équipe de recherche a ensuite mis en place des expériences pour voir si ces cNPs étaient absorbés par différents types de cellules. Dans une série de résultats prometteurs, les cNP ont été absorbés par plusieurs types de cellules, y compris les cellules tumorales du côlon26 cliniquement pertinentes (cellules cancéreuses dérivées de souris), les cellules de type macrophage RAW264.7 et les cellules NIH3T3 normales. Les cellules RAW264.7 sont couramment utilisées comme cribles in vitro pour les immunomodulateurs, des médicaments qui ciblent principalement diverses voies cancéreuses.
Les résultats ont été étonnants :parmi les trois types de cellules, les cNP n'ont inhibé que de manière significative la croissance des cellules du côlon26, indiquant leur sélectivité pour les lignées cellulaires cancérigènes. De plus, les cNP ont pu induire avec succès la libération du facteur de nécrose tumorale-α (TNF-α) à partir des cellules RAW264.7. C'est un fait bien documenté que le TNFα est principalement sécrété par les macrophages, les cellules tueuses naturelles et les lymphocytes, trois ingrédients clés de notre système immunitaire hautement évolué et qui aident à monter une réponse anticancéreuse. "La forte réponse du TNFα était encourageante et indiquait le rôle des cNP dans le traitement de divers types de cancer", explique le Dr Daisuke Sasaki, premier auteur de l'étude et instructeur et chercheur à TUS.
L'équipe de recherche a ensuite effectué un test de rapporteur avec l'enzyme "luciférase" (dérivée de lucioles), qui est un rapporteur sensible pour étudier diverses réponses biologiques. Ce test basé sur la luciférase a révélé que la puissante combinaison de cNP et de cellules RAW264.7 supprimait de manière significative la prolifération des cellules colon26. Enfin, l'équipe de recherche a étudié l'effet des cNP sur des souris de laboratoire porteuses de tumeurs sous-cutanées. Encore une fois, les résultats ont été étonnants :l'injection quotidienne de cNPs dans les tumeurs du côlon26 a supprimé de manière significative la croissance tumorale, sans provoquer d'effets secondaires graves ni de perte de poids.
"En optimisant les propriétés des nanoparticules et en les associant à des médicaments anticancéreux, nous espérons concevoir des médicaments sûrs et efficaces pour divers cancers", observe le professeur Nishikawa, optimiste.
Résumant ces découvertes percutantes, le Dr Kosuke Kusamori, co-auteur et professeur adjoint à TUS, déclare :"Ces NPc présentent d'excellentes propriétés anti-tumorales, sont faciles à développer et sont économiquement viables. De plus, ils ne présentent aucun effet indésirable grave. , du moins chez la souris jusqu'à présent." Comment les cellules immunitaires du microenvironnement tumoral aggravent les choses