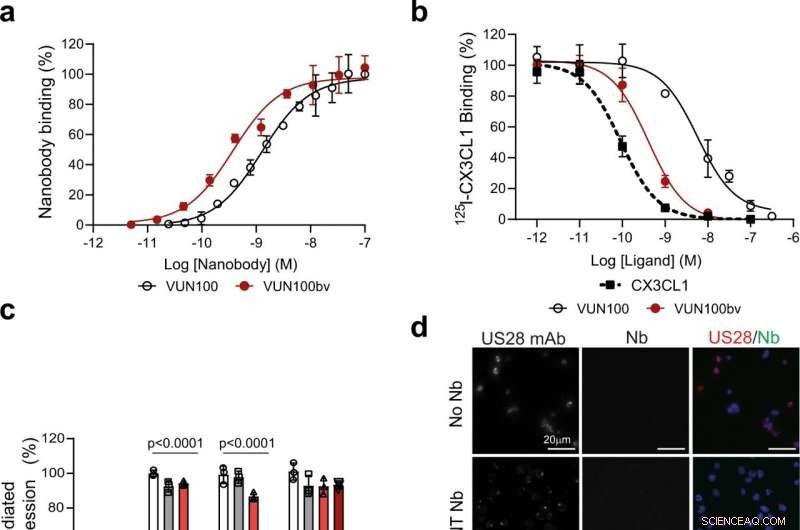
Fig. 1 :VUN100bv se lie et inhibe la signalisation US28. une Liaison ELISA de VUN100 monovalent et de VUN100bv bivalent à des extraits membranaires de cellules HEK293T exprimant US28. Chiffre représentatif de trois expériences indépendantes. b Déplacement de 125I-CX3CL1 à partir de membranes exprimant US28 par un ligand non marqué ou les nanobodies VUN100 et VUN100bv. Chiffre représentatif de trois expériences indépendantes. c Effet des nanobodies sur l'activation du NFAT (facteur nucléaire des cellules T activées) médiée par US28. Cellules HEK293T exprimant soit le rapporteur NFAT-luciférase uniquement (Mock) soit le rapporteur NFAT-luciférase avec le récepteur de type sauvage US28 (WT), Mutant US28 Y16F (Y16F), Mutant US28 ΔN (2–22) (ΔN (2–22)) ou mutant US28 R129A (R129A). Les cellules ont été non traitées (untr) ou traitées avec un nanocorps non ciblé (NT Nb), VUN100, ou VUN100bv pendant 24 h avant la mesure de luminescence. Les données ont été normalisées par rapport aux échantillons WT non traités. Chiffre représentatif de trois expériences indépendantes. ré Microscopie par immunofluorescence de nanocorps se liant aux cellules THP-1 exprimant US28. US28 a été détecté en utilisant un anticorps polyclonal de lapin anti-US28 (mAb US28). Les cellules ont été incubées sans nanocorps (No Nb), un NT Nb, VUN100, ou VUN100bv. Le nanocorps lié a été détecté en utilisant le Myc-tag présent sur les nanobodies et un anticorps anti-Myc (Nb). Chiffre représentatif de trois expériences indépendantes. e Détection par transfert Western pour les niveaux totaux d'IFI16 de lysats de cellules transduites simulées THP-1 non traitées (THP-1 Mock) ou de cellules THP-1 exprimant US28 (THP-1 US28 WT). Les cellules THP-1 US28 WT ont été non traitées (Untr) ou traitées avec NT Nb, VUN100, ou VUN100bv pour 48 h. Les niveaux de protéine IFI16 ont été déterminés et normalisés aux niveaux de protéine d'actine. Les niveaux relatifs de protéine IFI16 ont été normalisés par rapport aux lysats de cellules fictives THP-1 non traités. n = 3 expériences indépendantes à partir de trois répétitions biologiques indépendantes. Toutes les données sont tracées en moyenne ± S.D. Pour toutes les données, à l'exception de la figure 1c, des analyses statistiques ont été effectuées à l'aide d'un test t bilatéral non apparié. Pour la figure 1c, la signification statistique a été déterminée à l'aide de la méthode de Holm-Sidak (bilatérale avec alpha = 0,05). Les données source sont fournies sous forme de fichier de données source. Crédit :DOI :10.1038/s41467-021-24608-5
Les scientifiques ont développé un "nanobody" - un petit fragment d'anticorps de lama - capable de chasser le cytomégalovirus humain (HCMV) lorsqu'il se cache du système immunitaire. Cela permet ensuite aux cellules immunitaires de rechercher et de détruire ce virus potentiellement mortel.
On pense qu'environ quatre personnes sur cinq au Royaume-Uni sont infectées par le HCMV, et dans les pays en développement, ce chiffre peut atteindre 95 %. Pour la majorité des gens, le virus reste en sommeil, caché à l'intérieur des globules blancs, où il peut rester intact et non détecté pendant des décennies. Si le virus se réactive chez un individu sain, il ne provoque généralement pas de symptômes. Cependant, pour les personnes immunodéprimées, par exemple, les receveurs de greffe qui doivent prendre des médicaments immunosuppresseurs pour prévenir le rejet d'organes – la réactivation du HCMV peut être dévastatrice.
Maintenant, il n'existe pas de vaccin efficace contre le HCMV, et les médicaments antiviraux s'avèrent souvent inefficaces ou ont des effets secondaires très graves.
Maintenant, dans une étude publiée dans Communication Nature , des chercheurs de la Vrije Universiteit Amsterdam aux Pays-Bas et de l'Université de Cambridge ont trouvé un moyen de chasser le virus de sa cachette en utilisant un type spécial d'anticorps appelé nanocorps.
Les nanocorps ont été identifiés pour la première fois chez les chameaux et existent chez tous les camélidés, une famille d'animaux qui comprend également le dromadaire, lamas et alpagas. Les anticorps humains sont constitués de deux chaînes lourdes et de deux chaînes légères de molécules, qui, ensemble, reconnaissent et se lient à des marqueurs à la surface d'une cellule ou d'un virus appelés antigènes. Pour cette classe spéciale d'anticorps de camélidés, cependant, un seul fragment de l'anticorps, souvent appelé anticorps à domaine unique ou nanocorps, est suffisant pour reconnaître correctement les antigènes.
Dr Timo De Groof de la Vrije Universiteit Amsterdam, le co-premier auteur de l'étude, dit :"Comme son nom l'indique, les nanocorps sont beaucoup plus petits que les anticorps ordinaires, ce qui les rend parfaitement adaptés à des types particuliers d'antigènes et relativement faciles à fabriquer et à ajuster. C'est pourquoi ils sont salués comme ayant le potentiel de révolutionner les thérapies par anticorps. »
Le premier nanocorps a été approuvé et introduit sur le marché par la société biopharmaceutique Ablynx, tandis que d'autres nanobodies font déjà l'objet d'essais cliniques pour des maladies comme la polyarthrite rhumatoïde et certains cancers. Maintenant, l'équipe aux Pays-Bas et au Royaume-Uni a développé des nanobodies qui ciblent une protéine virale spécifique (US28), l'un des rares éléments détectables à la surface d'une cellule infectée de manière latente par le HCMV et un des principaux moteurs de cet état latent.
Le Dr Ian Groves du Département de médecine de l'Université de Cambridge a déclaré :« Notre équipe a montré que les nanocorps dérivés de lamas ont le potentiel de déjouer le cytomégalovirus humain. Cela pourrait être très important car le virus peut provoquer des complications potentiellement mortelles chez les personnes dont le système immunitaire ne fonctionne pas correctement."
Dans des expériences de laboratoire utilisant du sang infecté par le virus, l'équipe a montré que le nanocorps se lie à la protéine US28 et interrompt les signaux établis par la protéine qui aident à maintenir le virus dans son état dormant. Une fois ce contrôle rompu, les cellules immunitaires locales sont capables de « voir » que la cellule est infectée, permettant aux cellules immunitaires de l'hôte de traquer et de tuer le virus, purger le réservoir latent et nettoyer le sang du virus.
Dr Elizabeth Elder, co-premier auteur, qui a effectué son travail à l'Université de Cambridge, a déclaré:"La beauté de cette approche est qu'elle réactive le virus juste assez pour le rendre visible pour le système immunitaire, mais pas assez pour qu'il fasse ce qu'un virus fait normalement :se répliquer et se propager. Le virus est obligé de mettre sa tête au-dessus du parapet où il peut ensuite être tué par le système immunitaire."
Professeur Martine Smit, également de la Vrije Universiteit Amsterdam, a ajouté:"Nous pensons que notre approche pourrait conduire à un nouveau type de traitement indispensable pour réduire - et potentiellement même prévenir - le CMV infectieux chez les patients éligibles pour des greffes d'organes et de cellules souches."