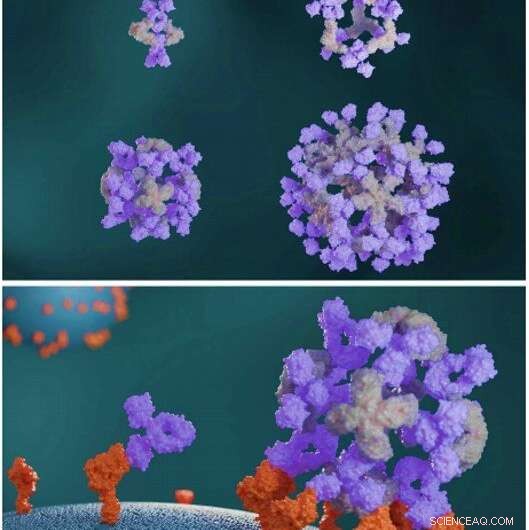
Les protéines conçues assemblent les anticorps dans de grandes architectures symétriques. Les protéines de regroupement d'anticorps conçues (gris clair) assemblent les anticorps (violet) dans diverses architectures de nanocages (en haut). Les nanocages d'anticorps améliorent la signalisation cellulaire par rapport aux anticorps libres (en bas). Crédit :Sciences, doi:10.1126/science.abd9994
Dans un nouveau rapport maintenant publié le Science , Robby Divine et une équipe de recherche interdisciplinaire du département de biochimie, médecine régénérative, et les vaccins et les maladies infectieuses à l'Université de Washington aux États-Unis et à l'École de médecine, à l'Université des sciences médicales de Téhéran, L'Iran, a mené des conceptions informatiques de nanocages pour assembler des anticorps dans des architectures précises. Pendant le chantier, un composant structurel a formé une fusion d'anticorps ou de ligand Fc et la seconde conception a formé un homo-oligomère de liaison aux anticorps pour conduire l'assemblage de nanocages avec différentes valences et symétries. L'équipe émet l'hypothèse que ce processus peut également augmenter la neutralisation d'un pseudovirus; coronavirus-2 du syndrome respiratoire aigu sévère (SRAS-COV-2) via des anticorps monoclonaux α-SARS-COV-2 et des protéines de fusion Fc-enzyme de conversion de l'angiotensine 2 (ACE-2).
Les anticorps dans la recherche médicale
Les anticorps qui se lient spécifiquement aux cibles d'intérêt jouent un rôle central dans la recherche biomédicale et la médecine. Les chercheurs peuvent générer des grappes d'anticorps en liant génétiquement des fragments d'anticorps pour améliorer la signalisation. Il est actuellement difficile de former des assemblages d'anticorps avec une variété d'architectures et de valences précises. Dans ce travail, Divin et al. des protéines conçues par ordinateur qui assemblaient des anticorps dans des architectures précises avec différentes valences et symétries. L'équipe a émis l'hypothèse que de telles conceptions pourraient conduire de manière robuste des anticorps arbitraires dans des nanocages homogènes et structurellement bien définis pour des effets prononcés sur la signalisation cellulaire. Les chercheurs ont conçu des protéines pour conduire l'assemblage d'anticorps arbitraires en assemblages symétriques avec des structures bien définies. Pour ça, ils ont fusionné de manière rigide trois types d'unités de "bloc de construction" contenant des domaines de liaison Fc d'anticorps, connecteurs à répétition hélicoïdale et modules de formation d'oligomères cycliques. Dans son architecture, l'unité de liaison au Fc s'est positionnée avec le dimère d'anticorps C2, l'homo-oligomère cyclique forme le deuxième axe de symétrie cyclique dans la nanocage, et le connecteur de répétition hélicoïdale a lié les axes de symétrie de l'anticorps et de l'homo-oligomère cyclique dans la bonne orientation pour former les nanocages d'anticorps appelées AbCs.
Conception de nanocage d'anticorps (AbC). (A) La géométrie polyédrique est spécifiée. Dans le sens horaire en partant du haut à gauche :icosaèdre, dièdre, octaédrique, et les géométries tétraédriques sont montrées. (B) Un modèle d'anticorps Fc de hIgG1 est aligné sur l'un des axes C2 (dans ce cas, un dièdre D2 est représenté). (C) Les liants Fc d'anticorps sont fusionnés à des connecteurs répétés hélicoïdaux qui sont ensuite fusionnés à la sous-unité monomère des oligomères cycliques hélicoïdaux. Toutes les combinaisons de blocs de construction et de jonctions de blocs de construction sont échantillonnées (encart inférieur en gris; les nombres entre parenthèses renvoient au nombre de blocs de construction disponibles). (D) Les fusions tripartites sont vérifiées pour assurer un alignement réussi des axes de symétrie C2 Fc avec celui de l'architecture polyédrique (dans le cas de la symétrie D2 montrée ici, les axes C2 doivent se couper à un angle de 90°). (E) Les fusions qui répondent aux critères géométriques avancent avec la refonte de la chaîne latérale, où, par exemple, les acides aminés sont optimisés pour garantir que les résidus de compactage du noyau sont non polaires et étroitement entassés et que les résidus exposés au solvant sont polaires. (F) Les oligomères conçus formant AbC sont exprimés par voie bactérienne, purifié, et assemblés avec l'anticorps Fc ou IgG. Crédit :Sciences, doi:10.1126/science.abd9994 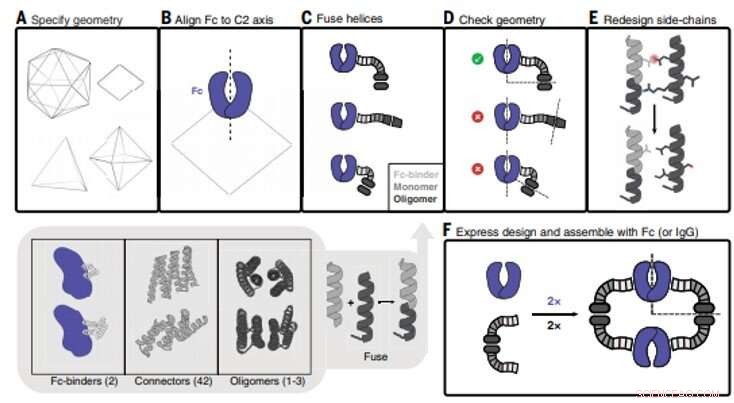
Pour former des conceptions de cage d'anticorps (AbC), Divin et al. des molécules de liaison au domaine constant d'anticorps fusionnées de manière rigide à des oligomères cycliques en utilisant des domaines d'espacement hélicoïdaux. Ils ont facilité le processus grâce à des domaines d'espacement hélicoïdaux afin que les axes de symétrie de l'anticorps dimère et de l'oligomère cyclique puissent être à des orientations qui ont généré diverses architectures dièdres ou polyédriques. Les scientifiques ont optimisé les régions de jonction entre les blocs de construction connectés pour se plier aux structures conçues. L'approche de fusion reposait sur de grands ensembles de blocs de construction avec de nombreux sites de fusion possibles par bloc de construction en tant que critères géométriques rigoureux pour former l'architecture symétrique souhaitée. L'équipe a utilisé une méthode informatique pour la conception de cages d'anticorps afin de générer des dièdres, tétraédrique, AbCs octaédriques et icosaédriques et ont utilisé une convention de dénomination pour décrire les architectures finales des nanocages. Divin et al. ensuite exprimé des gènes synthétiques codant pour les conceptions dans des cultures bactériennes d'Escherichia coli. Par exemple, les conceptions réussies comprenaient le décaèdre D-2 (trois conceptions), T-32 (une conception) et 152 architectures icosaédriques (deux conceptions) contenant deux, six, 12 ou 30 anticorps, respectivement. Ils ont caractérisé les Fc AbCs en utilisant la diffusion des rayons X aux petits angles et la microscopie électronique. Les nanocages reconstruites étaient en accord étroit avec les modèles de conception informatique. Pour évaluer la stabilité des nanocages, Divin et al. utilisé des lectures de diffusion dynamique de la lumière pour obtenir une stabilité encourageante pour permettre la caractérisation de leur impact biologique ensuite.
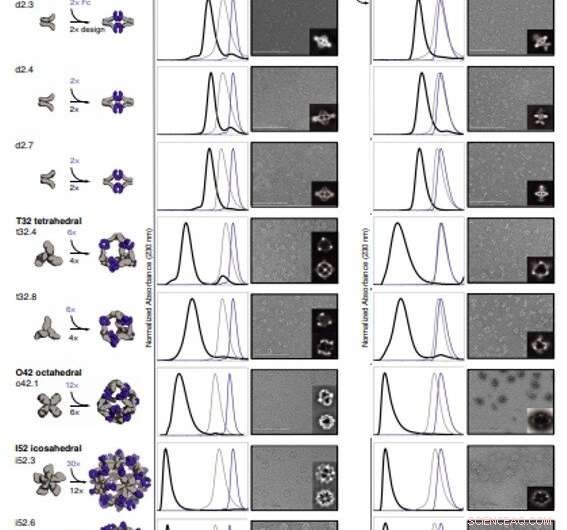
Caractérisation structurelle des AbCs. (A) Concevoir des modèles, avec l'anticorps Fc (violet) et des oligomères conçus formant AbC (gris). (B) Superposition de traces d'assemblage SEC représentatives formées en mélangeant la conception et Fc (noir) avec celles des composants uniques en gris (conception) ou violet (Fc). (C) images EM avec des moyennes de classe 2D sans référence en médaillon ; toutes les données sont de NS-EM, à l'exception des modèles o42.1 et i52.3 (cryo-EM). (D et E) Micrographies représentatives SEC (D) et NS-EM avec des moyennes de classe 2D sans référence (E) des mêmes cages d'anticorps conçues assemblées avec des IgG1 humaines complètes (avec les 2 régions Fab intactes). Dans tous les cas EM indiqués en (C) et (E), les assemblages ont d'abord été purifiés via SEC, et les fractions correspondant au pic le plus à gauche ont été regroupées et utilisées pour l'imagerie afin d'éliminer tout excès de conception ou de composant Ig. Barres d'échelle, 200 nm. Crédit :Sciences, doi:10.1126/science.abd9994
Effets sur la signalisation cellulaire
Les AbC conçus ont fourni une plate-forme générale pour comprendre l'effet de la valence et de la géométrie de l'engagement des récepteurs sur l'activation de la voie de signalisation. La large gamme d'anticorps de liaison aux récepteurs et de ligands naturels formés avec la méthode AbC développée dans ce travail a permis de sonder facilement et systématiquement l'effet de la géométrie et de la valence de l'association de sous-unités de récepteur sur la signalisation cellulaire pour presque toutes les voies. Pour explorer la praticité de cette approche, Divin et al. ont assemblé des anticorps ou des fusions Fc-ligand ciblant une variété de voies de signalisation dans des cages d'anticorps (AbC) et ont étudié leur impact sur la signalisation. Par exemple, les ABC, formé avec un anticorps ciblant le récepteur de la mort induit l'apoptose (mort cellulaire) de lignées cellulaires tumorales qui n'avaient jusqu'alors pas été affectées par l'anticorps soluble ou le ligand natif. En outre, l'assemblage de Fc-fusions ou d'anticorps dans des AbCs, a permis une signalisation améliorée de la voie de l'angiopoïétine, Signalisation du CD-40 et prolifération des lymphocytes T. La formation d'AbC a en outre permis la neutralisation d'un pseudovirus in vitro, tels que le coronavirus 2 du syndrome respiratoire aigu sévère.
Reconstructions 3D des AbC formés avec Fc. Les modèles de conception informatique (représentation de bande dessinée) de chaque AbC sont adaptés à la densité 3D déterminée expérimentalement à partir de l'EM. Chaque nanocage est vue le long d'un axe de symétrie inoccupé (à gauche) et tournée pour regarder vers le bas l'un des axes de symétrie C2 occupés par le Fc (à droite). Les reconstructions tridimensionnelles de o42.1 et i52.3 sont issues de l'analyse cryo-EM, tous les autres sont de NS-EM. Crédit :Sciences, doi:10.1126/science.abd9994 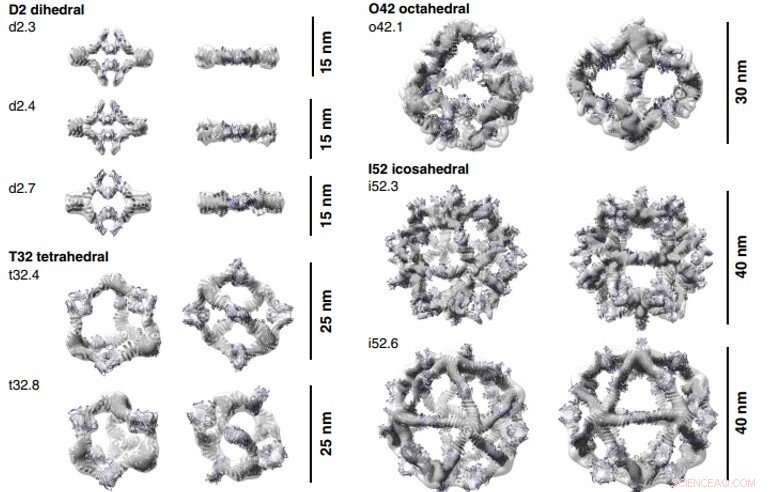
La méthode détaillée dans ce travail, est allé au-delà des efforts de conception informatique précédents pour créer des nanomatériaux protéiques qui intègrent forme et fonction. Les AbC ont donc utilisé des anticorps à la fois comme composants structurels et fonctionnels pour obtenir un large éventail de géométries et d'orientations. Cette stratégie est applicable à la conception de vaccins avec des nanocages assemblées avec des glycoprotéines virales en utilisant des composants se terminant par des domaines de liaison aux glycoprotéines pour maximiser la proximité des sites actifs. De cette façon, Robby Divine et ses collègues ont conçu plusieurs protéines formant des cages d'anticorps pour regrouper avec précision tout anticorps se liant aux protéines dans des nanocages grâce à une valence et une géométrie contrôlées. L'équipe en a utilisé deux, six et 12 ou 30 anticorps dans les AbC en mélangeant simplement l'anticorps avec la protéine conçue correspondante sans modifications covalentes supplémentaires. Les scientifiques ont ajouté des anticorps de liaison aux récepteurs ou de neutralisation des virus dans les ABC pour améliorer leur activité biologique dans divers systèmes cellulaires. L'équipe s'attend à ce que ce résultat pour l'assemblage rapide d'anticorps dans des nanocages ordonnés sans modifications covalentes ait de larges applications dans la recherche et la médecine.

Les AbC activent les voies de signalisation de l'apoptose et de l'angiogenèse. (A et B) La caspase-3/7 est activée par des AbC formés avec l'anticorps a-DR5 (A), mais pas l'anticorps libre, dans les cellules cancéreuses rénales RCC4 (B). (C et D) a-DR5 AbC (C), mais pas les contrôles Fc AbC (D), réduire la viabilité cellulaire 4 jours après le traitement. (E) Les AbC a-DR5 réduisent la viabilité 6 jours après le traitement. (F et G) o42.1 a-DR5 AbCs améliorent le clivage PARP, un marqueur de signalisation apoptotique; (G) est une quantification de (F) par rapport au contrôle PBS. (H) The F-domain from angiopoietin-1 was fused to Fc (A1F-Fc) and assembled into octahedral (o42.1) and icosahedral (i52.3) AbCs. (I) Representative Western blots show that A1F-Fc AbCs, but not controls, increase pAKT and pERK1/2 signals. (J) Quantification of (I):pAKT quantification is normalized to o42.1 A1F-Fc signaling (no pAKT signal in the PBS control); pERK1/2 is normalized to PBS. (K) A1F-Fc AbCs increase vascular stability after 72 hours. (Left) Quantification of vascular stability compared with PBS. (Right) Representative images; scale bars, 100 mm. All error bars represent means ± SEM; means were compared using analysis of variance and Dunnett post-hoc tests (tables S8 and S9). *P ≤ 0.05; **P ≤ 0.01; ***P ≤ 0.001; ****P ≤ 0.0001 Credit:Science, doi:10.1126/science.abd9994
© 2021 Réseau Science X