Nanocanaux fonctionnels pour la détection de la phosphorylation de la tyrosine. Crédit :QING Guangyan
La phosphorylation de la tyrosine (pTyr) peut initier la signalisation cellulaire et régir les fonctions cellulaires. Son dérèglement est impliqué dans de nombreuses maladies, surtout les cancers. La détection spécifique de pTyr-est importante pour le développement de médicaments anticancéreux ciblés.
L'approche couramment utilisée pour détecter pTyr repose sur le dosage radiométrique avec [γ- 32 P]-ATP comme substrat, qui souffre de l'utilisation de réactifs radioactifs nocifs et de la production de déchets radioactifs.
Des méthodes basées sur des anticorps et certains capteurs chimiques synthétiques ont également été développés pour obtenir une détection spécifique de pTyr pour les tests de dépistage d'inhibiteurs de kinases. Cependant, ces méthodes ne sont pas rentables.
Récemment, un groupe de recherche dirigé par le professeur Qing Guangyan de l'Institut de physique chimique de Dalian (DICP) de l'Académie chinoise des sciences a développé une nouvelle approche basée sur une plate-forme fonctionnelle de nanocanaux ioniques pour la détection spécifique de la phosphorylation de la tyrosine.
Les résultats ont été publiés dans le Journal de l'American Chemical Society le 7 septembre.
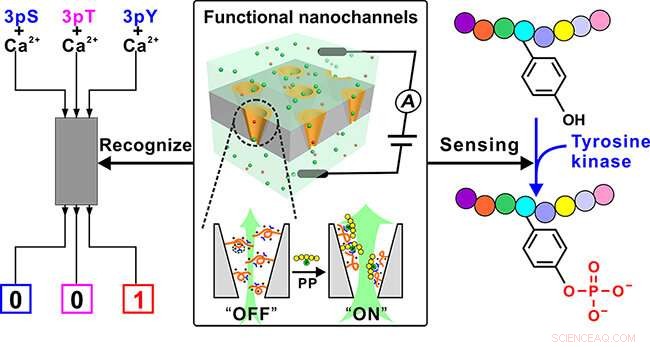
En imitant les multiples interactions des groupes guanidinium des résidus arginine avec les résidus phosphorylés dans les protéines, les chercheurs ont conçu un polymère fonctionnel porteur de groupements guanidinium riches pour modifier un substrat de nanocanaux ioniques, et développé un dispositif nanocanal fonctionnel.
Le polymère pourrait reconnaître le peptide phosphorylé (PP) grâce à la liaison du groupe guanidinium avec le groupe phosphate dans le PP, et amplifier une telle reconnaissance au changement de conformation du polymère lui-même. Plus loin, le changement de conformation a été converti en changement "OFF-ON" du flux ionique des nanocanaux, enfin réaliser la détection du PP au moyen du changement de courant ionique.
La reconnaissance spécifique du peptide pTyr de ses homologues pSer et pThr a été obtenue en construisant une simple porte logique nanofluidique lorsque Ca 2+ a été introduit en tant qu'élément contraignant concurrentiel.
Surtout, l'excellente capacité de détection de pTyr rend les nanocanaux fonctionnels disponibles pour le suivi en temps réel du processus pTyr par la tyrosine kinase sur un substrat peptidique, même dans un état compliqué, et l'étude de validation de principe de la surveillance de l'activité de la kinase démontre son potentiel dans le dépistage des inhibiteurs de la kinase.