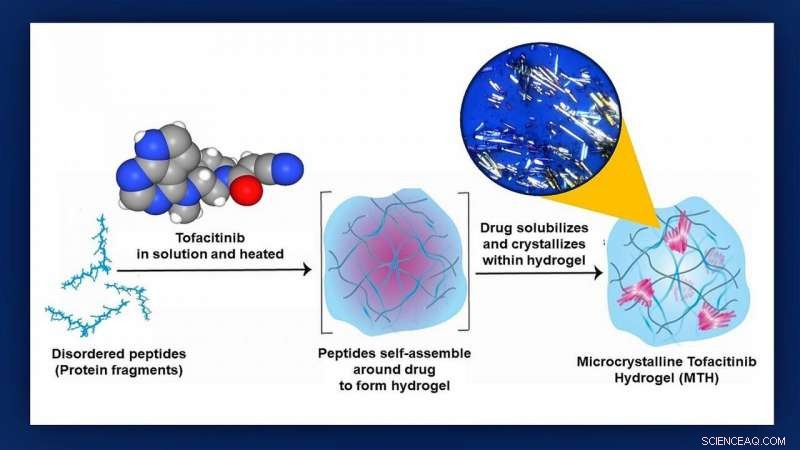
Les chercheurs de Johns Hopkins Medicine et du NCI Frederick ont démontré chez la souris qu'ils peuvent facilement administrer une thérapie anti-rejet prometteuse directement à un cœur transplanté en l'emballant dans un petit cocon de gel de protéines appelé hydrogel. Les étapes de construction de l'hydrogel et d'encapsulation du médicament, tofacitinib, sont illustrés dans ce graphique. L'encart en haut à droite est une photomicrographie réelle des cristaux de tofacitinib en place Crédit :graphique créé par M.E. Newman, Médecine Johns Hopkins, en utilisant une illustration originale de Poulami Majumder et le modèle moléculaire du tofactinib avec l'aimable autorisation du National Center for Biotechnology Information
Pour les patients qui recevront une transplantation cardiaque dans un avenir proche, le vieil adage, "Les bonnes choses viennent en petits paquets, " peuvent devenir des mots à vivre. Dans une étude récente, des chercheurs de Johns Hopkins Medicine et du National Cancer Institute (NCI) ont démontré chez des souris qu'elles peuvent facilement administrer un médicament anti-rejet prometteur directement dans la zone entourant un cœur greffé en l'emballant dans un minuscule tridimensionnel, cocon de gel de protéine connu sous le nom d'hydrogel. Le meilleur de tous, les chercheurs disent que la libération du médicament est étalée dans le temps, le rendant hautement régulable et éliminant le besoin de médicaments quotidiens pour contrôler le rejet.
Les résultats sont présentés dans le 18 août, 2020, numéro de la revue Petit .
Prévenir le rejet d'un cœur transplanté a souvent été une situation attrape-22. Si vous donnez à un receveur d'organes de grandes quantités de médicaments immunosuppresseurs, il peut y avoir des effets secondaires graves, y compris les lésions rénales, hypertension, déséquilibres glycémiques et même lymphomes. Abaisser la dose peut être plus sûr pour la santé générale, mais augmente le risque que le rejet ne soit pas correctement contrôlé et que le cœur greffé soit perdu.
"Ce qu'il fallait, c'était une méthode d'administration du médicament qui permettrait d'obtenir le médicament anti-rejet uniquement là où c'était nécessaire ; protéger le médicament d'une dégradation prématurée ; et maintenir une concentration élevée pendant la période de temps nécessaire pour recycler le système immunitaire, " déclare le co-auteur de l'étude Giorgio Raimondi, M.Sc., Doctorat., professeur adjoint de chirurgie plastique et reconstructive à la faculté de médecine de l'Université Johns Hopkins.
"Deux études antérieures ont utilisé la méthode de l'hydrogel pour administrer avec succès des médicaments immunosuppresseurs conventionnels à d'autres sites, et cela nous a incité à l'essayer pour les cœurs transplantés, " explique Raimondi. " De plus, travail d'une équipe du NCI Frederick National Laboratory for Cancer Research sous la direction de Joel Schneider [Ph.D., un co-auteur de l'étude] a montré que les paquets d'hydrogel-médicament peuvent être administrés par seringue. »
Le médicament que ces chercheurs voulaient fournir aux cœurs transplantés est le tofacitinib, un inhibiteur du processus par lequel les cellules alertent leur réceptivité à la liaison avec des protéines induisant l'inflammation appelées cytokines. Dans les réponses immunitaires normales aux envahisseurs étrangers dans le corps, les cytokines jouent un rôle essentiel en alertant les globules blancs spécialisés (lymphocytes T) pour attaquer et éliminer les bactéries ou virus menaçants. Cependant, les cytokines en présence d'un cœur greffé peuvent diriger le système immunitaire pour détruire le greffon.
Pour voir si un coursier d'hydrogel pourrait être utilisé pour livrer le tofacitinib, les chercheurs ont d'abord greffé des cœurs de souris dans le cou de souris receveuses pour créer un modèle animal de greffe humaine. Prochain, ils ont mélangé du tofacitinib avec une solution de petits fragments de protéines qui se sont assemblés autour du médicament au cours d'un processus d'incubation de 24 heures que Raimondi compare aux kits "faites votre propre cristal" populaires auprès des enfants.
"Nous avons découvert que transformer le tofacitinib en un cristal contrôlait mieux la façon dont le médicament se répandait à partir de l'hydrogel, " déclare l'auteur principal de l'étude Poulami Majumder, Doctorat., ancien NCI à Frederick boursier postdoctoral. "L'hydrogel de tofacitinib microcristallin résultant, ' ou MTH, était extrêmement stable, préservait le médicament encapsulé en parfait état et pouvait être injecté sur le site de transplantation simplement à l'aide d'une seringue. »
Les chercheurs ont testé le système d'administration de MTH dans leur modèle de souris en tandem avec un deuxième médicament immunosuppresseur, CTLA4-Ig, qui a été injecté séparément. C'était la première fois que cette combinaison thérapeutique spécifique était essayée.
Pour déterminer si l'emplacement de la livraison MTH était important, les chercheurs ont injecté le médicament conditionné localement, sur le site de transplantation, et au loin, près de la queue de la souris. Comme prévu, seul le groupe de souris avec des injections locales a montré une augmentation significative du temps de survie du greffon.
"La survie moyenne des cœurs greffés dans le groupe injecté localement était d'environ 125 jours contre seulement 35 jours pour les souris injectées avec MTH loin de la greffe, " dit Raimondi. " Nous avons également testé le plasma du premier groupe et n'avons trouvé que des traces minimalement détectables de tofacitinib, ce qui signifie que l'administration de MTH maintient le médicament à proximité du site de transplantation et lui permet d'agir en synergie avec CTLA4-Ig pour fournir une protection renforcée et durable de l'orgue."
Sans le traitement tofactinib/CTLA4, Raimondi dit, les cœurs de souris transplantés ont cessé de battre dans les 10 jours.
Raimondi dit que l'un des avantages de l'utilisation du MTH comme système d'administration de médicaments est que l'hydrogel libère son contenu lentement, sur une période de 5 à 20 jours, et ne provoque pas d'autres complications car il est biocompatible, non inflammatoire et biodégradable. Lui et ses collègues pensent que l'utilisation de l'ingénierie cristalline pour améliorer encore la capsule d'hydrogel, un meilleur contrôle sur le taux de libération peut être obtenu - un objectif essentiel à atteindre avant que des essais humains puissent être tentés - ou, la capsule peut être rendue « ajustable » pour délivrer le médicament uniquement lorsque le cœur greffé est attaqué par le système immunitaire.
Les chercheurs estiment également qu'avec des recherches et des tests supplémentaires, le système d'administration MTH pourrait être appliqué à la lutte contre le rejet d'organes transplantés autres que le cœur et au traitement des maladies auto-immunes.