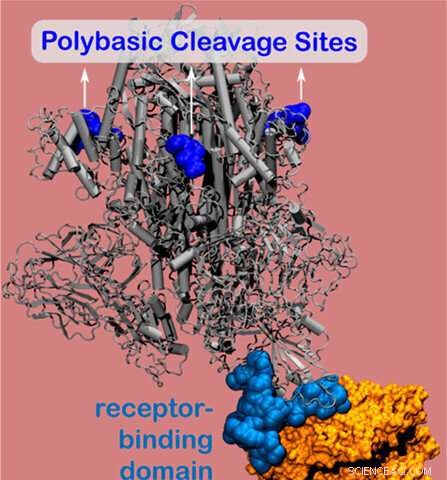
Modèle informatique montrant des sites de clivage poly basiques sur la protéine de pointe du nouveau coronavirus. Crédit :Université Northwestern.
Des chercheurs de l'Université Northwestern ont découvert une nouvelle vulnérabilité dans la tristement célèbre protéine de pointe du nouveau coronavirus, éclairant une méthode relativement simple, voie de traitement potentielle.
La protéine de pointe contient le site de liaison du virus, qui adhère aux cellules hôtes et permet au virus d'entrer et d'infecter le corps. À l'aide de simulations au niveau du nanomètre, les chercheurs ont découvert un site chargé positivement (connu sous le nom de site de clivage polybasique) situé à 10 nanomètres du site de liaison réel sur la protéine de pointe. Le site chargé positivement permet une forte liaison entre la protéine virale et les récepteurs cellulaires humains chargés négativement.
Fort de cette découverte, les chercheurs ont conçu une molécule chargée négativement pour se lier au site de clivage chargé positivement. Le blocage de ce site empêche le virus de se lier à la cellule hôte.
"Nos travaux indiquent que le blocage de ce site de clivage peut agir comme un traitement prophylactique viable qui diminue la capacité du virus à infecter les humains, " a déclaré Monica Olvera de la Cruz de Northwestern, qui a dirigé les travaux. "Nos résultats expliquent les études expérimentales montrant que les mutations de la protéine de pointe SARS-CoV-2 ont affecté la transmissibilité du virus."
La recherche a été publiée en ligne la semaine dernière dans la revue ACS Nano .
Olvera de la Cruz est la professeure Lawyer Taylor de la science et de l'ingénierie des matériaux à la McCormick School of Engineering de Northwestern. Baofu Qiao, professeur assistant de recherche dans le groupe de recherche d'Olvera de la Cruz, est le premier auteur de l'article.
Composé d'acides aminés, Les sites de clivage polybasique du SRAS-CoV-2 sont restés insaisissables depuis le début de l'épidémie de COVID-19. Mais des recherches antérieures indiquent que ces sites mystérieux sont essentiels à la virulence et à la transmission. Olvera de la Cruz et Qiao ont découvert que le site de clivage polybasique est situé à 10 nanomètres des récepteurs cellulaires humains, une découverte qui a fourni un aperçu inattendu.
"Nous ne nous attendions pas à voir des interactions électrostatiques à 10 nanomètres, " dit Qiao. " Dans des conditions physiologiques, toutes les interactions électrostatiques ne se produisent plus à des distances supérieures à 1 nanomètre."
"La fonction du site de clivage polybasique est restée insaisissable, " a déclaré Olvera de la Cruz. " Cependant, il semble être clivé par une enzyme (furine) abondante dans les poumons, ce qui suggère que le site de clivage est crucial pour l'entrée du virus dans les cellules humaines."
Avec ces nouvelles informations, Olvera de la Cruz et Qiao prévoient ensuite de travailler avec des chimistes et des pharmacologues du Nord-Ouest pour concevoir un nouveau médicament qui pourrait se lier à la protéine de pointe.