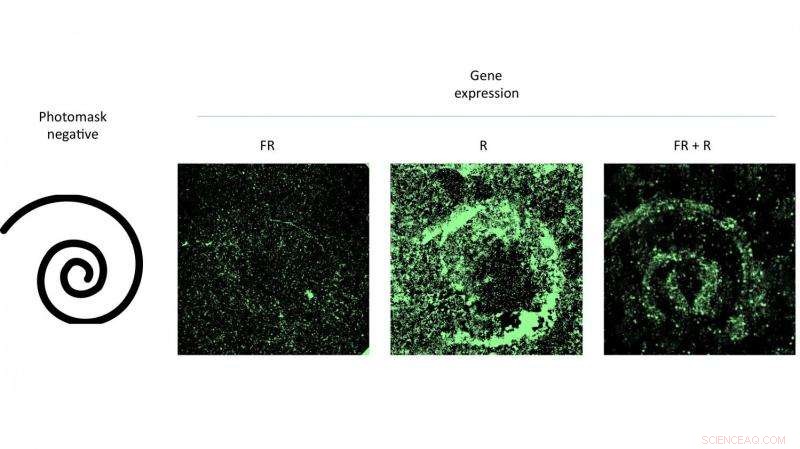
Frapper une boîte de Pétri de cellules contenant un virus modifié avec une lumière rouge à motifs a encouragé l'expression de gènes correspondant au motif. L'expérience menée par des scientifiques de l'Université Rice a prouvé l'efficacité d'un nouveau système de délivrance de gènes qui peut être contrôlé par la lumière. Crédit :Eric Gomez/Rice University
La lumière aide les scientifiques de l'Université Rice à contrôler à la fois l'infectiosité des virus et la livraison de gènes aux noyaux des cellules cibles.
Les chercheurs ont développé une méthode pour utiliser deux nuances de rouge pour contrôler le niveau et la distribution spatiale de l'expression des gènes dans les cellules via un virus modifié.
Bien que les virus aient évolué pour transmettre des gènes aux cellules hôtes, ils ont toujours des difficultés à faire passer leurs charges utiles du cytoplasme dans le noyau d'une cellule, où se produit l'expression des gènes. Les laboratoires Rice des bio-ingénieurs Junghae Suh et Jeffrey Tabor ont réussi à trouver un moyen de surmonter cet obstacle critique.
Les recherches de l'équipe paraissent cette semaine dans le journal de l'American Chemical Society ACS Nano .
Le résultat des laboratoires de Rice's BioScience Research Collaborative combine l'intérêt de Suh pour la conception de virus pour délivrer des gènes aux cellules cibles avec les compétences de Tabor en optogénétique, dans lequel des protéines sensibles à la lumière peuvent être utilisées pour contrôler le comportement biologique.
Ils ont construit des vecteurs de virus adéno-associés (AAV) personnalisés en incorporant des protéines qui se réunissent naturellement lorsqu'elles sont exposées à la lumière rouge (longueurs d'onde de 650 nanomètres) et se séparent lorsqu'elles sont exposées au rouge lointain (longueurs d'onde de 750 nanomètres). Ces protéines naturellement sensibles à la lumière aident les capsides virales - les coquilles dures qui contiennent des charges utiles génétiques - à pénétrer dans les noyaux de la cellule hôte.
L'AAV a été le vecteur de choix pour l'édition de gènes via CRISPR/Cas9, une technique prometteuse pour guérir certaines maladies génétiques, mais les noyaux cellulaires posent problème, Suh dit.

Eric Gomez, étudiant diplômé de l'Université Rice, tient un masque à motif en spirale qu'il a utilisé pour contrôler les modèles d'expression des gènes dans une boîte de Pétri. Les cellules de la boîte contenaient un virus modifié qui répondait à la lumière rouge et livrait ses cargaisons génétiques aux noyaux des cellules. Crédit :Jeff Fitlow/Université Rice
"Les virus en général sont relativement efficaces pour introduire des gènes dans les cellules, mais ils connaissent encore de grandes barrières limitantes, " dit-elle. " Si vous ajoutez ces virus aux cellules, la plupart d'entre eux semblent traîner en dehors du noyau, et seule une petite fraction fait son chemin à l'intérieur, qui est le but."
Elle a déclaré que l'équipe s'est appuyée sur l'expertise du laboratoire Tabor en optogénétique pour augmenter l'efficacité des AAV. "Jeff travaille avec de nombreux types différents de protéines sensibles à la lumière. La paire particulière que nous avons choisie a été identifiée pour la première fois dans les plantes.
"La lumière est vraiment agréable car vous pouvez l'appliquer à l'extérieur et vous pouvez contrôler de nombreux aspects :à quelles zones la lumière est exposée, la durée d'exposition, l'intensité de la lumière et, bien sûr, sa longueur d'onde, " elle a dit.
La paire de protéines comprend le phytochrome B et son partenaire de liaison phytochrome interacting factor 6 (PIF6), tous deux trouvés dans le cresson de thale. Les chercheurs ont généré des cellules hôtes qui expriment le phytochrome B marqué avec une séquence de localisation nucléaire, un petit peptide connu pour aider à transporter les protéines dans le noyau plus efficacement. Le plus petit PIF6 a ensuite été attaché à la surface extérieure de la capside du virus.
"Lorsque les virus sont internalisés dans une cellule hôte, ils s'accumulent naturellement autour du noyau, " dit Suh. " Dans des conditions non activées, la plupart des virus y sont bloqués. Mais lorsque nous éclairons les cellules en activant la lumière rouge, ces deux protéines végétales se dimérisent - elles se rejoignent - et en raison de l'étiquette de localisation nucléaire sur le phytochrome B, le virus est entraîné dans le noyau."
C'est la première fois que des protéines optogénétiques sont utilisées pour contrôler l'infectiosité des virus, elle a dit, ajouter, "Nous ne pensions pas que cela fonctionnerait aussi bien que cela."

Le bio-ingénieur de l'Université Rice Junghae Suh, la gauche, et l'étudiant diplômé Eric Gomez a dirigé une étude dans laquelle les protéines qui répondent à la lumière ont aidé les capsides virales à livrer leur contenu aux noyaux des cellules. Les chercheurs voient leur technique comme un moyen de contrôler l'expression des gènes. Crédit :Jeff Fitlow/Université Rice
Auteur principal Eric Gomez, un étudiant diplômé du laboratoire de Suh, et co-auteur Karl Gerhardt, un étudiant diplômé du laboratoire de Tabor, a démontré la technique en activant des motifs de cellules infectées par l'AAV dans des boîtes de Pétri en leur envoyant une lumière rouge à travers des masques.
Suh a déclaré que la plate-forme pourrait être utilisée à l'avenir pour contrôler quelles cellules et quels tissus expriment un gène et à quel niveau. La stratégie pourrait également trouver une utilisation dans des applications d'ingénierie tissulaire comme les bioéchafaudages pour l'implantation. "Ici, vous voudrez peut-être amener les cellules souches à se développer en les bonnes cellules d'une manière coordonnée dans l'espace, " elle a dit.
L'utilisation dans le corps est plus éloignée, parce que la lumière rouge appliquée de l'extérieur ne traverse que les tissus pour atteindre les cibles. "Finalement, cela va dépendre de l'appareil que vous utilisez pour fournir la lumière, " dit-elle. " Mais nous imaginons des cas où vous pourriez utiliser un cathéter pour aller à l'endroit où vous voulez que les virus soient beaucoup plus infectieux. "
Suh a déclaré que les laboratoires Rice s'efforcent de rendre la prochaine génération de capsides à la fois plus efficace et plus livrable. "Ce n'est que la première étape, " dit-elle. " Nous avons beaucoup de questions, comme « pouvons-nous vraiment faire cela in vivo ? » genre de questions.
"Il y a eu une poignée d'articles essayant de rendre le processus infectieux viral sensible à la lumière, mais ils étaient avant l'ère de l'optogénétique, " dit Suh. " Ils utilisaient d'autres types de molécules synthétiques pour rendre les virus sensibles à la lumière.
"Il semble que l'utilisation de ce que Mère Nature a déjà fourni sous forme de protéines sensibles à la lumière fonctionne très bien pour nous."