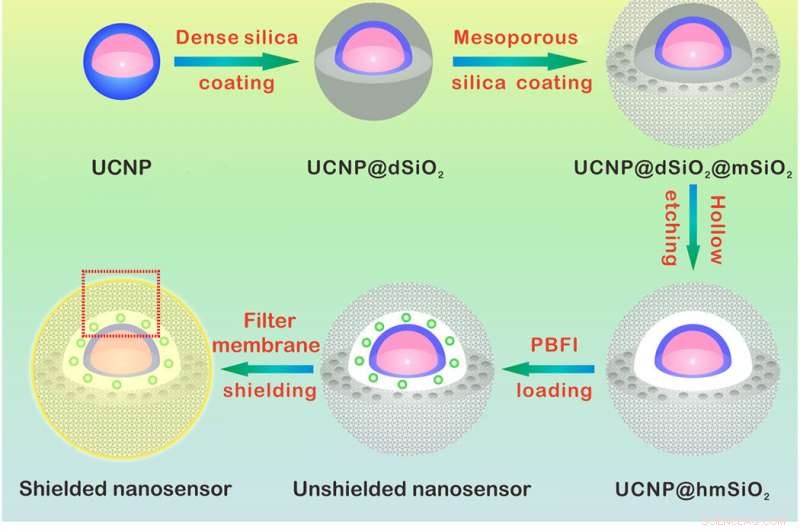
Conception et mécanisme de détection du nanocapteur K+. (A) Illustration schématique de la synthèse du nanocapteur. Le cœur NaYF4:Yb/Tm@NaYF4:Yb/Nd (UCNP) a été synthétisé et recouvert d'une couche de silice dense et d'une coquille de silice mésoporeuse successive. La gravure de la couche de silice dense forme une cavité creuse qui permet le chargement de PBFI. Le nanocapteur a enfin été recouvert de la membrane filtrante K+-sélective. (B) Schémas montrant une vue agrandie du nanocapteur [de la boîte en pointillé rouge dans (A)] et de son mécanisme de détection K +. La couche de membrane filtrante permet uniquement au K+ de diffuser dans et hors du nanocapteur, excluant ainsi l'interférence d'autres cations. Une fois diffusé dans le nanocapteur, K+ se liera immédiatement à PBFI. Lors d'une irradiation NIR, la lumière UV convertie des UCNP excite PBFI, conduisant à l'émission de PBFI lié au K+. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aax9757
Les chercheurs ont développé un certain nombre d'ions potassium (K + ) sondes pour détecter les fluctuations de K + concentrations au cours de divers processus biologiques. Cependant, de telles sondes ne sont pas suffisamment sensibles pour détecter les fluctuations physiologiques chez les animaux vivants et il n'est pas facile de surveiller les tissus profonds avec des excitations à courte longueur d'onde qui sont utilisées jusqu'à présent. Dans un nouveau rapport, Jianan Liu et une équipe de chercheurs en neurosciences, chimie, et l'ingénierie moléculaire en Chine, décrivent un nanocapteur hautement sensible et sélectif pour le proche infrarouge (NIR) K + imagerie ionique dans les cellules vivantes et les animaux. L'équipe a construit le nanocapteur en encapsulant des nanoparticules de conversion ascendante (UCNP) et un indicateur commercial d'ions potassium dans la cavité creuse de nanoparticules de silice mésoporeuses et les a recouvertes d'un K + membrane filtrante sélective. La membrane adsorbée K + du milieu et filtré tous les cations interférents. Dans son mécanisme d'action, Les UCNP ont converti le NIR en lumière ultraviolette (UV) pour exciter l'indicateur d'ions potassium et détecter les concentrations fluctuantes d'ions potassium dans les cellules en culture et dans les modèles animaux de maladie, y compris les souris et les larves de poisson zèbre. Les résultats sont maintenant publiés sur Avancées scientifiques .
Le cation intracellulaire le plus abondant potassium (K + ) est extrêmement crucial dans une variété de processus biologiques, y compris la transmission neuronale, battement de coeur, contraction musculaire et fonction rénale. Variations du K intracellulaire ou extracellulaire + concentration (appelée ici [K + ]) suggèrent des fonctions physiologiques anormales, y compris un dysfonctionnement cardiaque, cancer, et le diabète. Par conséquent, les chercheurs sont désireux de développer des stratégies efficaces pour surveiller la dynamique de [K + ] fluctuations, spécifiquement avec l'imagerie optique directe.
La plupart des sondes existantes ne sont pas sensibles à K + détection dans des conditions physiologiques et ne peut pas différencier les fluctuations entre [K + ] et l'ion sodium qui l'accompagne ([Na + ]) lors du transport transmembranaire dans le Na + /K + pompes. Alors que l'imagerie de fluorescence à vie peut distinguer K + et Na + en solution aqueuse, la méthode nécessite des instruments spécialisés. La plupart des K + les capteurs sont également activés avec de la lumière à courte longueur d'onde, y compris la lumière ultraviolette (UV) ou visible, ce qui entraîne une diffusion importante et une profondeur de pénétration limitée lors de l'examen des tissus vivants. En revanche, la technique d'imagerie proche infrarouge (NIR) proposée offrira des avantages uniques lors de l'imagerie des tissus profonds en tant qu'alternative plausible.
Caractérisation structurale du nanocapteur K+. (A à C) Images annulaires en champ sombre à grand angle de UCNP@dSiO2 (A), UCNP@dSiO2@mSiO2 (B), et UCNP@hmSiO2 (C). (D) Image de microscopie électronique à balayage (MEB) du nanocapteur blindé. (E) Image SEM du nanocapteur blindé immergé dans une solution aqueuse contenant 150 mM de Na+, 150 mMK+, 2 mM de Ca2+, 2 mM de Mg2+, 50 M Fe2+, 2 mM Zn2+, 50 M Mn2+, et 50 M de Cu2+. (F) Les profils de balayage de ligne élémentaire EDS le long de la ligne blanche en (E) révèlent que seuls les signaux K + sont présents dans les mésopores et les cavités creuses des nanocapteurs blindés. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aax9757 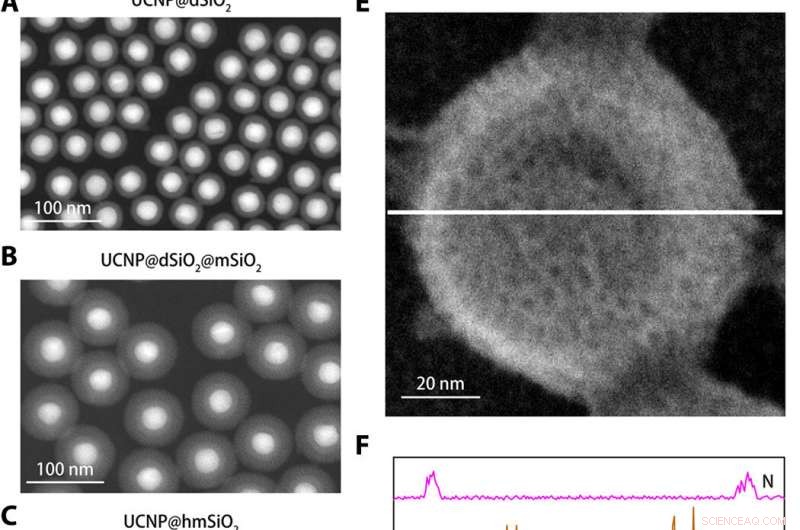
Pour concevoir le nanocapteur, Liu et al. nanoparticules de conversion ascendante encapsulées (UCNP) et un K commercial + indicateur :l'isophtalate de benzofurane fixant le potassium (PBFI) dans le cœur des nanoparticules de silice mésoporeuses (MSN). Les UCNP ont pu convertir la lumière NIR en lumière UV et exciter l'accepteur du K + indicateur par transfert d'énergie de résonance de luminescence. Ils ont protégé la surface externe des nanoparticules de silice avec une fine couche de K + membrane filtrante sélective avec des micropores créés à partir d'oxygène carbonyle pour la spécificité. La configuration a favorisé le transfert gratuit de K + à travers le pore membranaire, tout en empêchant d'autres cations biologiquement pertinents de se diffuser. La technique leur a permis de détecter de légères fluctuations de [K + ] dans la solution. L'équipe a utilisé la microscopie électronique à transmission (MET) pour observer la structure et l'apparence bien contrôlées des nanoparticules à chaque étape de la construction du nanocapteur. La diffusion dynamique de la lumière a confirmé la présence d'une membrane filtrante à la surface du nanocapteur blindé.
Imagerie de l'efflux de K+ dans les cellules HEK 293. (A) Schémas montrant la détection de l'efflux de K+ par un nanocapteur conjugué à la streptavidine, qui est attaché à une cellule modifiée par la biotine. (B) Images de microscopie confocale montrant la fluorescence (à 400 à 500 nm et 500 à 600 nm) de cellules HEK 293 marquées par nanocapteur à différents moments après traitement avec le stimulateur d'efflux K + (un mélange de 5 M de nigéricine, 5 M de bumétanide, et 10 M d'ouabaïne). (C) Évolution dans le temps des variations de fluorescence du nanocapteur et de la dépendance temporelle calculée du taux d'efflux K + après traitement avec un stimulateur d'efflux K +. (D) Fluctuations de fluorescence dépendantes du temps de cellules HEK 293 marquées par un nanocapteur blindé après des traitements avec différentes concentrations (20, 40, 60, 80, et 100%) de stimulateur d'efflux K+. Les résultats de cinq expériences indépendantes ont été résumés en moyenne ± SEM en (C) et (D). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aax9757 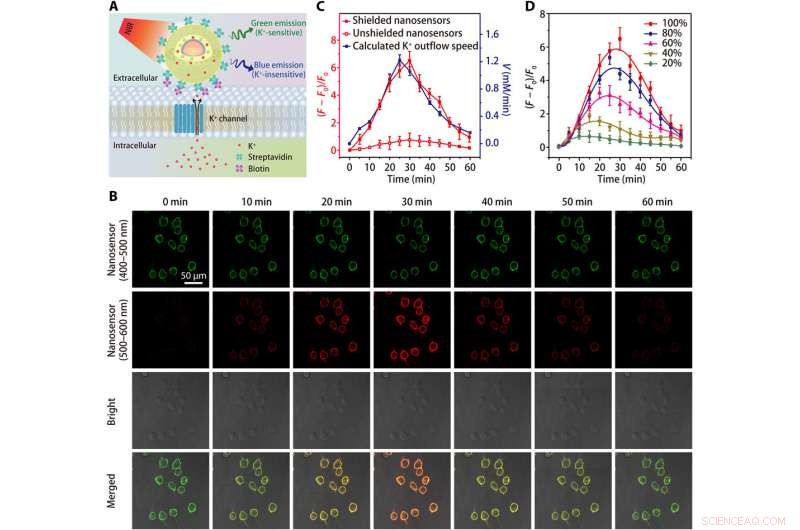
L'équipe a testé la sensibilité améliorée du nanocapteur blindé dans une plage physiologique (0 à 150 mM) et a montré une augmentation de 12 fois de l'intensité de fluorescence par rapport aux nanocapteurs non blindés. Le K + les sondes devaient afficher une sélectivité élevée contre Na + , que Liu et al. vérifié à l'aide du nanocapteur blindé en détectant rapidement une sensibilité de fluorescence constante aux fluctuations [K + ], tout en n'étant pas affecté par l'augmentation de [Na + ].
Étant donné que les cellules vivantes dépendent de l'adénosine triphosphatase sodium-potassium (Na
+
/K
+
pompe) pour maintenir une pente [K
+
] gradient à travers leur membrane plasmique, le processus est en partie responsable de la dépense énergétique de la cellule. Des défauts dans le métabolisme énergétique cellulaire peuvent entraîner une perte du [K
+
] pente, tout en donnant naissance à des [K
+
] connu sous le nom de [K
+
]
Résultats d'imagerie K+ du cerveau de souris traité par des nanocapteurs blindés lors de l'initiation d'une dépression propagée par le déclenchement de KCl. La vidéo intégrale est huit fois plus rapide que la vitesse réelle. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aax9757 
L'équipe a ensuite appliqué le nanocapteur blindé pour étudier la dépression à propagation corticale (CSD) dans le cerveau de la souris en tant que propagation ondulatoire de l'activité neuronale. Le processus implique généralement une libération lente de propagation de K
+
dans la surface corticale et pourrait être déclenchée dans le cerveau de souris via une incubation de chlorure de potassium (KCl). Les scientifiques ont simultanément surveillé le potentiel de champ local et le signal optique à travers la fenêtre crânienne chirurgicale et ont observé une vague de [K
+
]
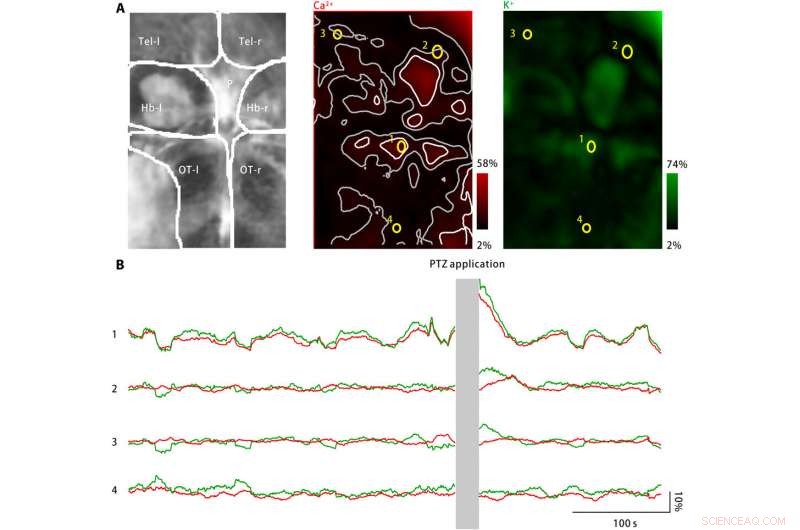
Le potassium extracellulaire a éclaté dans le cerveau des larves de poisson zèbre lors d'un traitement PTZ. (A) Le traitement PTZ a induit des augmentations à la fois de l'activité du calcium neuronal (au milieu) et de la concentration de potassium extracellulaire (à droite). Gauche :les zones cérébrales imagées comprennent les télencéphales gauche et droit (Tel-l et Tel-r, respectivement), les habenules gauche et droite (Hb-l et Hb-r, respectivement), le corps pinéal (P), et les tecta optiques gauche et droite (OT-l et OT-r, respectivement). Milieu :L'activité neuronale du calcium a été surveillée à l'aide d'un indicateur de calcium génétiquement exprimé, jRGECO1a. L'amplitude de réponse mesurée est codée en rouge et mappée vers la région du cerveau imagée. Les taches d'activité dispersées sont marquées en blanc, et leurs zones voisines sont marquées en gris. Quatre ROI (jaunes) sont sélectionnées. À droite :la concentration de potassium extracellulaire a été surveillée à l'aide du nanocapteur de potassium. L'amplitude de réponse mesurée est codée en vert et mappée vers la région du cerveau imagée. (B) L'activité neuronale du calcium (rouge) et les concentrations de potassium extracellulaire observées pour les quatre ROI représentatives sont indiquées en (A). Après application PTZ, l'activité du calcium neuronal et la concentration de potassium extracellulaire ont augmenté à plusieurs points d'activité, y compris le corps pinéal et la tecta optique antérieure, tel que représenté par ROI1. Aux zones voisines des sites d'activités, la modification de l'activité calcique neuronale est absente ou minime, tandis que la concentration extracellulaire de potassium continue d'augmenter (ROI2 et ROI3). Cependant, dans la zone éloignée des lieux d'activités (ROI4), ni l'activité calcique neuronale ni la concentration extracellulaire de potassium n'ont augmenté. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aax9757
Pour étendre les applications du nanocapteur, Liu et al. surveillé les niveaux de calcium neuronal et les concentrations de potassium extracellulaire à l'aide de larves de poisson zèbre. Alors qu'une forte augmentation de la concentration de potassium extracellulaire peut provoquer une activation neuronale intense pour provoquer la CSD et l'épilepsie, aucune preuve directe n'existe pour montrer des changements dans le potassium extracellulaire au cours de la maladie. L'équipe a donc conçu un modèle de maladie utilisant des larves de poisson zèbre pour augmenter les concentrations de potassium extracellulaire et a observé une activation neuronale caractéristique de la maladie dans des régions spécifiques du cerveau.
De cette façon, Jianan Liu et ses collègues ont conçu un nanocapteur d'ions potassium avec une sensibilité et une sélectivité extrêmement élevées. Le revêtement externe d'une membrane filtrante sélective a amélioré la sélectivité, sensibilité, et la cinétique du dispositif pour une rapide et quantitative [K + ] détection dans des cellules vivantes et des cerveaux intacts. Le nanocapteur blindé aura de larges applications dans la recherche sur le cerveau pour améliorer la compréhension des anomalies [K + maladies liées à ]. La méthode associée à l'endoscope à fibre optique et à la photométrie permettra une imagerie du potassium en temps réel chez les animaux se déplaçant librement.
© 2020 Réseau Science X