Crédit :Société chimique américaine
Les scientifiques du monde entier se précipitent pour trouver des inhibiteurs du SRAS-CoV-2, le nouveau coronavirus à l'origine de la pandémie de COVID-19. Certains utilisent des simulations informatiques pour identifier des composés prometteurs avant de mener des expériences réelles en laboratoire. Maintenant, chercheurs rapportant dans ACS Nano ont utilisé la modélisation informatique pour évaluer quatre peptides qui imitent le domaine de liaison au virus de la protéine humaine qui permet au SARS-CoV-2 d'entrer dans les cellules.
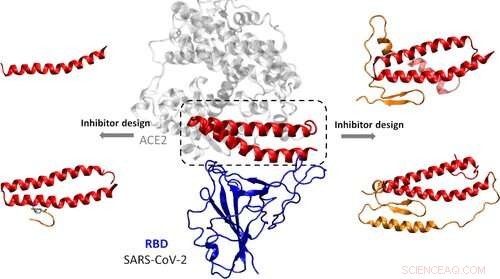
Pour infecter les cellules, Le SARS-CoV-2 utilise sa protéine de pointe pour se fixer au récepteur ACE2, une protéine à la surface de certaines cellules humaines. Cet attachement permet au virus de fusionner avec la membrane de la cellule hôte et d'y entrer. De nombreux chercheurs ont essayé de trouver des composés qui bloquent les régions clés de la protéine de pointe, empêcher le virus d'infecter les cellules. Yanxiao Han et Petr Král voulaient utiliser la modélisation informatique pour concevoir des composés qui imitent la cible naturelle de la protéine de pointe, ACE2.
Faire cela, les chercheurs ont examiné la structure cristalline aux rayons X récemment publiée du domaine de liaison au récepteur du SRAS-CoV-2 lorsqu'il est lié à l'ACE2. Ils ont identifié 15 acides aminés de l'ACE2 qui interagissent directement avec la protéine virale. Puis, les chercheurs ont conçu quatre inhibiteurs qui contiennent la plupart ou la totalité de ces acides aminés, avec des séquences supplémentaires qui, selon eux, stabiliseraient les structures. Grâce à des simulations informatiques, l'équipe a étudié comment les inhibiteurs pourraient se fixer à la protéine de pointe dans le corps et les énergies nécessaires à la liaison. L'un des composés s'est particulièrement bien adapté à la protéine virale. Le peptide doit encore être testé en laboratoire et chez les patients, mais pouvoir affiner les candidats-médicaments sur l'ordinateur pourrait aider à accélérer ce processus, dit l'équipe.