
Ascenseur moléculaire. Crédit :Daria Sokol/MIPT
Des biophysiciens de l'Institut de physique et de technologie de Moscou et de l'Université de Groningue aux Pays-Bas ont visualisé un cycle de transport presque complet de l'homologue du transporteur de glutamate mammifère d'archées. Ils ont confirmé que le mécanisme de transport ressemble à celui d'un ascenseur :une "porte" s'ouvre, les ions et les molécules de substrat entrent, la porte se ferme, et ils voyagent à travers la membrane. Vraisemblablement, les transporteurs de mammifères fonctionnent de la même manière, cette découverte est donc potentiellement importante pour le développement de nouveaux traitements contre la schizophrénie et d'autres maladies mentales causées par un dysfonctionnement de ces transporteurs. La recherche a été publiée dans la revue Communication Nature .
Les impulsions nerveuses traversent le corps humain sous forme de signaux chimiques ou de charges électriques, comme courants ioniques. Neurones, les cellules du système nerveux, peut générer et propager des signaux électriques. Un neurone est constitué d'un corps cellulaire avec des projections de deux types :plusieurs dendrites et un seul axone. Le corps cellulaire et les dendrites servent d'antenne captant les signaux d'autres neurones. En additionnant et en traitant tous les signaux d'entrée, le neurone génère ses propres impulsions qui sont ensuite transmises au neurone voisin. L'impulsion électrique dans un axone est similaire au courant électrique dans les fils, mais il est porté par les ions sodium et calcium, plutôt que des électrons. Cela dit, la transmission du signal électrique n'est possible qu'à l'intérieur d'un neurone. Les signaux transmis entre neurones sont de nature chimique et font intervenir des structures particulières, appelés synapses.
Le signal dans une synapse est généralement transporté par des produits chimiques appelés neurotransmetteurs. Un neurone libère des neurotransmetteurs dans la fente synaptique, et la membrane du neurone récepteur reconnaît le neurotransmetteur via un récepteur dédié.
Une autre étape cachée mais vitale de ce processus est que les molécules de neurotransmetteur doivent être retirées de la fente synaptique pour permettre la prochaine transmission d'impulsions. Autrement, le neurone récepteur sera surstimulé. Les neurotransmetteurs sont éliminés par des transporteurs dédiés qui pompent ces molécules de la fente synaptique vers le corps cellulaire. Ces transporteurs sont localisés soit dans les synapses des neurones, soit dans les cellules dites gliales, qui soutiennent et protègent les neurones (fig. 1).
Le glutamate est le principal neurotransmetteur excitateur du cerveau humain. Lorsque le glutamate est libéré dans la fente synaptique, cela excite le neurone suivant dans la séquence. Le système nerveux humain possède également des neurotransmetteurs inhibiteurs, par exemple le GABA (acide gamma-aminobutyrique), qui étouffe tout potentiel dans le neurone lorsqu'il est libéré.
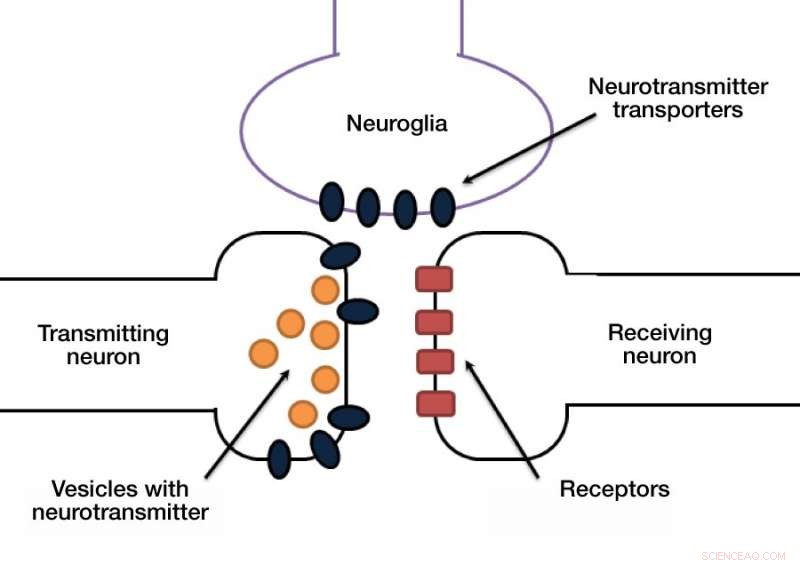
Figure 1. Crédit Synapse :Anastasia Vlasova/MIPT
Le transporteur de glutamate élimine le glutamate de la fente synaptique. Ce processus est crucial pour le fonctionnement du cerveau humain. L'inhibition de l'élimination du glutamate de la fente est liée à de nombreuses maladies neurodégénératives et troubles mentaux, y compris la schizophrénie.
Très souvent, nous pouvons en apprendre beaucoup sur quelqu'un en regardant simplement ses proches. Il en va de même pour les protéines évolutives similaires, appelés homologues. Le groupe de scientifiques russes et néerlandais a résolu un ensemble conformationnel du transporteur d'aspartate d'archaea, qui est homologue aux transporteurs de glutamate chez l'homme.
Jusque récemment, La cristallographie aux rayons X était la principale technique pour étudier les structures 3-D des protéines. Le principal défi rencontré par cette méthode consiste à cristalliser des protéines pour obtenir des images de diffraction à partir de cristaux. Les protéines membranaires ont tendance à ne pas former facilement des cristaux bien diffractants.
Pour surmonter ce goulot d'étranglement, une autre technique appelée cryomicroscopie électronique peut être utilisée. En cryo-EM, un échantillon vitrifié est irradié par un faisceau d'électrons et les images collectées sont combinées, donnant une reconstruction tridimensionnelle de la protéine. Le modèle obtenu est analysé et peut être utilisé pour concevoir de nouveaux médicaments.
La structure de l'homologue du transporteur de glutamate de mammifère a été déterminée à l'aide d'un microscope cryoélectronique à l'Université de Groningen aux Pays-Bas. Ces protéines sont constituées de trois molécules individuelles, ils forment donc des trimères. Chaque protomère individuel se compose de deux parties :la partie immobile fixée dans la membrane et le domaine de transport mobile ressemblant à un ascenseur. L'étude a révélé 15 structures de protomères (dans cinq trimères), y compris les conformations intermédiaires. L'équipe a également confirmé les mouvements indépendants des domaines de transport.
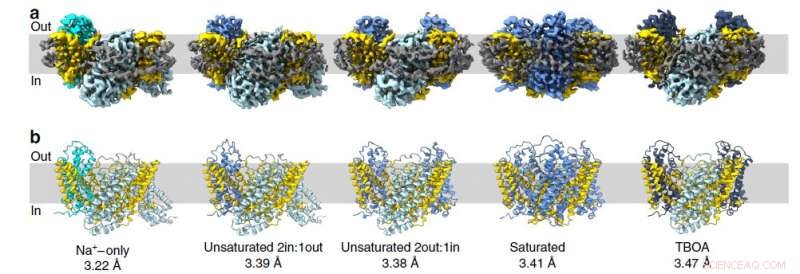
Figure 2. La structure du transporteur de glutamate des archées dans différents états. Chaque image représente un instantané dans lequel les protomères sont présentés dans les états suivants :vers l'intérieur ouvert (bleu acier), apo occluse vers l'extérieur intermédiaire (cyan), Asp occlus intermédiaire-extérieur (bleu bleuet), TBOA ouvert vers l'extérieur (bleu foncé) Crédit :Valentina Arkhipova et al./Nature Communications
« Ces structures nous aident à expliquer comment ces protéines empêchent les fuites de sodium, " le responsable du Laboratoire MIPT de Microscopie Electronique Structurale des Systèmes Biologiques, Albert Guskov a expliqué. "Comme dans un ascenseur, le domaine des transports a une porte, et tant qu'il reste ouvert, l'ascenseur ne bougera pas. Mais une fois que les ions sodium et le substrat - dans ce cas, les molécules d'aspartate — entrez dans l'ascenseur, la porte se ferme, et c'est parti. Donc, s'il n'y a que des ions sodium présents, cela ne suffit pas pour fermer la porte."
« Cela rend le transport très efficace, ce qui est particulièrement important dans le cas des protéines humaines, puisqu'il ne s'agit pas simplement de manger l'aspartate - comme chez les archées - mais de transférer des informations entre les neurones, " a ajouté le scientifique.
Le Laboratoire de Microscopie Electronique Structurale des Systèmes Biologiques, dirigé par le professeur Guskov, met en place une infrastructure scientifique moderne au MIPT, permettant la recherche à cycle complet sur la cryo-EM monoparticule en Russie. En 2019, l'équipe a lancé une plate-forme de recherche basée sur le microscope cryoélectronique FEI Polara G2 avec d'autres plans pour le mettre à niveau vers le microscope de pointe.
« Les compétences du laboratoire sont très demandées dans la communauté scientifique russe, et le réseau universitaire international en expansion permet l'accès à une infrastructure scientifique moderne. Une telle infrastructure ouvre de nouvelles perspectives pour étudier les questions fondamentales de la biologie, tels que les mécanismes de fonctions des canaux et transporteurs ioniques, interactions au sein de complexes protéiques, etc. Cela nous aide également à trouver des partenaires industriels qui mèneraient des recherches pour appliquer nos découvertes dans la conception de médicaments et ailleurs en médecine, " a commenté le professeur Guskov.