
Reconfiguration des motifs des parois fluides. Voir le film complet sur, Crédit :Avancées scientifiques, doi:10.1126/sciadv.aav8002
Les plaques de culture cellulaire utilisées quotidiennement en biologie peuvent être efficacement transformées en dispositifs microfluidiques, ouvrant la voie aux biologistes pour miniaturiser les flux de travail basés sur les cellules. Dans un récent rapport, doctorat le chercheur Cristian Soitu et ses collègues des départements des sciences de l'ingénieur et de la pathologie de l'Université d'Oxford, Oxford, ROYAUME-UNI., décrit une méthode simple pour créer des arrangements microfluidiques autour des cellules. Dans l'étude, les cellules poussaient déjà sur des surfaces de boîtes de Pétri standard, lorsque les scientifiques ont utilisé l'interface entre les milieux fluides non miscibles dans le conteneur comme matériau de construction.
Ils ont transformé les boîtes de culture cellulaire conventionnelles en dispositifs microfluidiques sophistiqués à la demande en remodelant les structures fluides autour des cellules vivantes. Soitu décrit la nouvelle technique de mise en forme des fluides construite par son équipe de recherche comme "des structures fluides pour les cellules qui craignent de s'engager lors du choix d'une maison - elles peuvent être facilement retirées et de nouvelles (avec une géométrie différente) construites". La recherche est maintenant publiée sur Avancées scientifiques
Les chercheurs ont démontré la méthode en utilisant des flux de travail impliquant le clonage cellulaire; clonage sélectif d'un clone spécifique parmi d'autres dans une boîte; traitements médicamenteux; et cicatrisation des plaies. Les travaux de recherche ont démontré une approche polyvalente, couplé à des fonctionnalités biologiquement conviviales pour promouvoir la technologie microfluidique parmi les biologistes. Les approches basées sur la microfluidique ont gagné en popularité dans de nombreux workflows, bien que leur adoption dans la biologie traditionnelle reste lente en raison d'une variété de raisons contributives, comprenant:
Autrefois, les scientifiques ont créé des constructions 3D avec des parois fluides à l'échelle nanométrique, bien que leur biocompatibilité reste à évaluer. Dans le travail present, donc, Soitu et al. a développé une méthode pour fabriquer des matrices de chambres microfluidiques isolées sur des boîtes de Pétri vierges pour s'adapter aux principaux flux de travail en biologie cellulaire. Des exemples possibles incluent l'alimentation et le transfert de cellules, clonage, cryoconservation, fixation et immunomarquage, lyse cellulaire et transcription inverse par amplification en chaîne par polymérase (RT-PCR) et édition de gènes CRISPR-Cas9. Dans des expériences précédentes de tels flux de travail, les scientifiques ont ajouté les cellules après la fabrication microfluidique.
Dans le travail present, les chercheurs ont créé une variété d'arrangements microfluidiques sur des boîtes de Pétri standard contenant des cellules adhérentes et les ont reconfigurés en temps réel. Ils ont isolé et récupéré des clones cellulaires pour effectuer des tests de validation de principe et des tests de cicatrisation des plaies et ont introduit la nouvelle technique pour créer et reconfigurer des circuits microfluidiques sur des boîtes de Pétri pendant que les cellules se développent et se divisent. avec de nombreuses applications potentielles en biologie traditionnelle.
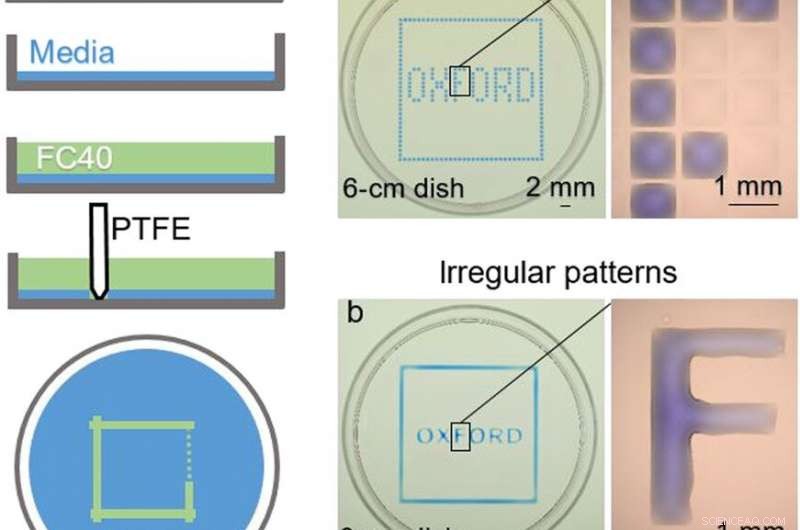
EN HAUT :Construction de la chambre. (A) Principe. Le milieu Eagle modifié de Dulbecco (DMEM) + 10% de sérum bovin foetal (FBS) est ajouté à une boîte de Pétri vierge, et la majeure partie du support est retirée pour laisser un film mince recouvrant le fond, qui est recouvert de FC40. Le stylet est déplacé vers le bas pour créer un agencement microfluidique. Une fois terminé, le volume initial de DMEM + 10% FBS sera divisé en deux parties séparées par une paroi liquide continue de FC40 épinglée au substrat. (B) Différents modèles. (a) La formation de lignes verticales et horizontales équidistantes crée un réseau (32 × 32 ; espacement de 1 mm). Prochain, 60 nl de colorant bleu sont ajoutés par l'imprimante aux chambres sélectionnées ; les chambres périphériques reçoivent du colorant bleu pour donner le carré bleu, et les internes donnent le mot "OXFORD". Le grossissement (à droite) montre des chambres individuelles sans et avec colorant. (b) Un motif similaire est créé en formant deux carrés (un légèrement plus grand que l'autre) avec le stylet, puis en ajoutant manuellement du colorant dans l'espace entre les deux ; chaque lettre est faite en formant ses côtés et en remplissant à nouveau manuellement l'intérieur. Le grossissement montre que la lettre "F" est un corps continu de liquide. Crédit photo :Cristian Soitu, Université d'Oxford. EN BAS :Reconfiguration des arrangements microfluidiques. Les images montrent des images du film. (1) Un premier motif est imprimé :un cercle (rayon, 1,5 mm) à l'intérieur d'un triangle (côté, 7 mm) à l'intérieur d'un carré (côté, 9 millimètres). (2 à 4) Des colorants différents sont ajoutés dans chaque compartiment (1,5 l de colorant rouge, 1,5 l de colorant jaune, et 5 µl de colorant bleu); les colorants sont confinés dans les murs du FC40. (5) Plus de colorant jaune est ajouté au cercle. (6) Après avoir ajouté 3 l de colorant jaune, la ligne d'épinglage circulaire se rompt et le contenu se répand dans le triangle. (7) Après avoir ajouté 24 l, la ligne d'épinglage triangulaire se rompt et le contenu se répand dans le carré. (8) Soixante microlitres sont retirés du carré. (9) Un nouveau motif est imprimé—un triangle (côté, 4,5 mm) dans un cercle (rayon, 3,3 mm) - dans le carré initial. (10 à 12) Des colorants colorés sont ajoutés aux trois compartiments différents comme précédemment. Crédit photo :Cristian Soitu, Université d'Oxford. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aav8002
La nouvelle technique et les expériences de preuve de concept
Dans les expériences qui ont suivi, les chercheurs ont d'abord recouvert le fond d'une boîte de Pétri avec du milieu de culture tissulaire et ont retiré la majeure partie du milieu pour former un film mince recouvrant le substrat en polystyrène. Ils ont recouvert le film mince d'un fluorocarbure non miscible (FC40) pour empêcher l'évaporation et comme barrière contre les contaminants externes pour maintenir la stérilité du milieu. Puis à l'aide d'une pointe en Téflon, les chercheurs ont contacté le fond du plat, déplacer la phase aqueuse pour former des arrangements microfluidiques sous la forme d'intérêt - dans ce cas, un carré. En utilisant la technique, les chercheurs ont apporté les avantages de la plate-forme microfluidique ouverte aux équipements de culture cellulaire standard.
Soitu et al. façonné la phase aqueuse pour créer une grille avec de faibles volumes de liquide comme précédemment démontré par la même équipe, et les regarda avec des colorants sélectifs dans des chambres sélectives. Par exemple, les chambres périphériques ont reçu un colorant bleu (formant un carré bleu) et celles à l'intérieur ont formé le mot "OXFORD".

Création de chambres pour l'isolement de clones cellulaires. Voir le film complet sur, Crédit :Avancées scientifiques, doi:10.1126/sciadv.aav8002
Les chercheurs ont « imprimé » un cercle dans un triangle dans un carré et ont utilisé des microlitres de trois colorants pour visualiser séparément les trois formes ; où FC40 empêchait les colorants de se mélanger. Les résultats ont montré la capacité de construire et de détruire les parois du FC40 pour confiner efficacement les liquides dans n'importe quelle forme 2D souhaitée.
Après les résultats préliminaires de la preuve de concept, Soitu et al. généré des réseaux de chambres pour récapituler le clonage de cellules tumorales mammaires de souris (NM18), pour lesquels ils ont initialement créé des grilles, suivi par l'ajout de cellules par la suite. Les chercheurs ont d'abord laissé les cellules se développer librement entourées par la paroi du FC40 perméable à la fois à l'O
Ils ont montré que des parois fluides avec différentes empreintes 2D pouvaient être facilement construites autour de cellules vivantes, tant que les colonies sont restées isolées les unes des autres pendant le traitement ou le prélèvement ultérieur. Des études antérieures qui ont fait pousser des cellules dans des espaces confinés, les surfaces pré-imprimées nécessitaient un traitement de surface avant l'adhésion cellulaire, ce qui contribue à l'exception notable de la technique actuelle.
Applications dans la cueillette de clones et les tests de dépistage de drogues
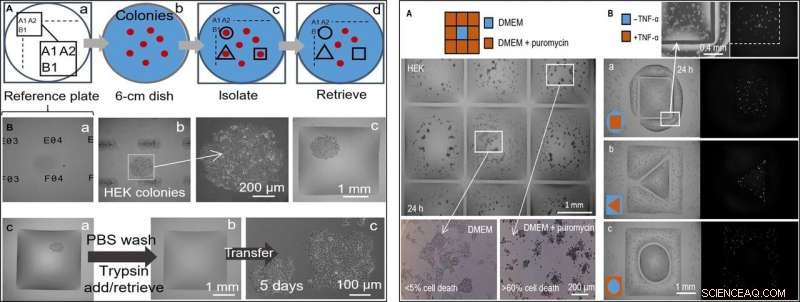
À GAUCHE :Cueillette sélective semi-automatique de clones (cellules HEK). L'imprimante ajoute/enlève un microlitre aux/des chambres à différentes étapes. (A) Approche. (a) Les emplacements sur une « plaque de référence » en verre sont marqués par des identifiants uniques (c. A1, A2 …, B1…). (b) Un plat de 6 cm avec des colonies (rouge) est placé sur la plaque de référence. (c) Après avoir enregistré les emplacements des colonies et les avoir entrés dans un script, des parois fluides sont imprimées autour des clones sélectionnés (lignes noires). (d) Les clones sont récupérés dans ces chambres. (B) Isoler un clone. Les cellules HEK ont été étalées à faible densité (~1 cellule/cm2) et cultivées (8 jours) en clones, le plat a été placé sur une plaque de référence, et des murs ont été construits autour de clones sélectionnés. Trois vues différentes de l'axe z d'un clone sont présentées. (a) Plaque de référence avec des identifiants uniques mis au point. (b) Colonie nette (identifiants flous) avec grossissement. (c) Colonie après la construction des murs d'enceinte. (C) Sélection de clones. (a) Mur carré construit autour d'une colonie vivante. L'imprimante lave les cellules en ajoutant/récupérant 1 µl de PBS; il ajoute ensuite 1 l de trypsine. (b) La boite est incubée (37°C; 5 min) pour détacher les cellules de la surface, et l'imprimante récupère 1 ul contenant la suspension riche en cellules (et la transfère dans un tube de microcentrifugation) pour quitter la chambre maintenant vide. (c) Les cellules récupérées sont étalées manuellement dans une plaque de microtitration à 12 puits et cultivées de manière conventionnelle pendant 5 jours; les cellules s'attachent et se développent. À DROITE :Deux traitements médicamenteux côte à côte avec des cellules non traitées. Des parois fluides ont été construites autour des cellules HEK (300, 000 cellules ; boîte de 6 cm) cultivée pendant 24 heures. (A) Puromycine (grille 3 × 3 ; chambres de 2 mm × 2 mm). L'imprimante ajoute 1 l de milieu à la chambre centrale et 1 l de milieu + puromycine aux périphériques (concentration finale, 10 µg/ml), comme indiqué dans le dessin animé. La viabilité cellulaire est évaluée après incubation (37°; 24 heures) à l'aide d'un test d'exclusion au bleu trypan. Les cellules des chambres extérieures sont mortes (plus de 60% dans chacune), tandis que ceux du centre restent vivants (moins de 5% de mort cellulaire). Ce test a été répliqué trois fois. (B) TNF-a. Des paires de chambres aux formes distinctes sont imprimées, l'un entourant l'autre. L'imprimante ajoute 0,5 l de milieu ± TNF-α (concentration finale, 10 ng/ml) à l'un ou l'autre volume (comme dans les dessins animés). Comme les cellules codent pour un gène rapporteur GFP contrôlé par un promoteur activé par le TNF-α, ils émettent une fluorescence verte lors de l'exposition à la cytokine. Les images de fluorescence montrent que seules les cellules du volume traité émettent une fluorescence verte. Les paires de volumes avaient les dimensions suivantes :(a) carré (côté, 1,8 mm) en cercle (rayon, 1,75 mm); (b) triangle (côté, 1 mm) en carré (côté, 3,5 mm); (c) cercle (rayon, 1 mm) en carré (côté, 3,5 mm). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aav8002
A l'étape suivante, les chercheurs ont créé une plaque de référence sur laquelle ils ont placé une boîte contenant des colonies de cellules vivantes d'intérêt pour isoler les clones cellulaires d'intérêt des autres en imprimant des parois fluides autour d'eux. Sur l'isolement, ils pouvaient choisir les colonies, récupérer les cellules et les faire croître de manière conventionnelle pour se multiplier comme prévu. Étant donné que les parois fluides pourraient effectivement confiner les liquides, Soitu et al. testé leur efficacité en ajoutant de la puromycine - un inhibiteur de traduction de petites molécules qui tue les cellules de mammifères.
Dans le dispositif expérimental de criblage de médicaments, ils ont permis à la chambre centrale de recevoir le milieu de croissance seul, tandis que le médicament a été délivré aux chambres environnantes à une dose mortelle élevée, pour montrer l'efficacité de la séparation FC40 lorsque seules les lignées cellulaires dans la chambre centrale ont survécu. Dans un deuxième exemple, Soitu et al. ont exploité la propriété d'une lignée de cellules rénales embryonnaires humaines génétiquement modifiées pour coder un gène promoteur fluorescent vert. Qui s'est allumé en présence du facteur de nécrose tumorale-α au vert fluorescent. Les parois fluides formaient des barrières efficaces à l'exposition aux médicaments, vérifier le potentiel de dépistage de drogues de la technique.
Applications en cicatrisation
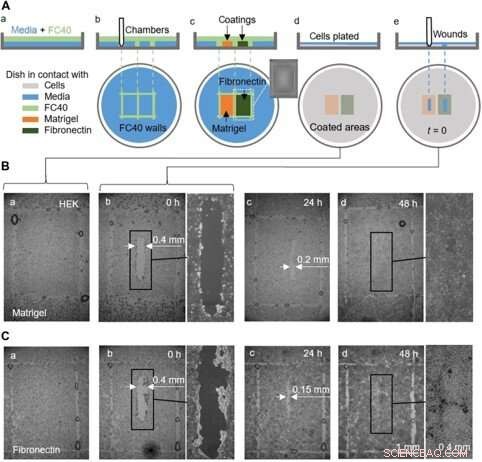
Un essai de cicatrisation des plaies de preuve de concept utilisant une boîte enduite de Matrigel et de fibronectine dans différentes régions. (A) Dessin animé illustrant le flux de travail. (a) Une fine couche de médium est recouverte de FC40. (b) Deux chambres (3 mm × 4 mm chacune) sont imprimées côte à côte. (c) Les surfaces des chambres sont recouvertes de Matrigel ou de fibronectine (2 l; concentration finale de 1 g/cm2; 1 heure); l'encart montre une image d'une chambre. Les parois fluides sont maintenant détruites, et la boîte est lavée avec 3 ml de milieu pour éliminer les revêtements non fixés. (d) cellules HEK (600, 000) sont plaqués dans le plat. (e) Après 24 heures, les cellules ont formé une monocouche, et une plaie (0,4 mm × 2 mm) est créée en grattant le stylet sur la surface pour éliminer les cellules sur son passage. La cicatrisation de la plaie est maintenant contrôlée au microscope. (B et C) Images de plaies en monocouches cultivées sur Matrigel ou fibronectine. (a et b) Immédiatement avant et après la blessure (quelques gouttelettes de FC40 restent là où les murs se trouvaient à l'origine). (c) Après 24 heures, la croissance cellulaire réduit la largeur des plaies à <0,2 mm et <0,15 mm avec le Matrigel et la fibronectine, respectivement. (d) Avant 48 heures, les blessures sont complètement cicatrisées. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aav8002
Ils ont également effectué des essais de preuve de principe de cicatrisation des plaies en utilisant un seul plat revêtu de deux manières différentes, pour surveiller deux conditions de cicatrisation. Pour ça, les chercheurs ont utilisé le Matrigel, une protéine gélatineuse sécrétée par les cellules du sarcome et la fibronectine, une glycoprotéine de la matrice extracellulaire qui a amélioré la cicatrisation des plaies. Ils ont ajouté des cellules HEK qui formaient une monocouche dans les boîtes et créaient une "plaie" en faisant glisser la pointe en téflon sur la monocouche lorsque les cellules migraient dans les plaies à des vitesses légèrement différentes. Bien que dans ce workflow Soitu et al. pré-enduit la surface avant le placage des cellules, ils pourraient également modifier la technique de revêtement pour son ajout après que les cellules ont commencé à migrer dans les plaies nouvellement formées pour favoriser la cicatrisation.
De cette façon, Cristian Soitu et ses collaborateurs ont développé un plateforme microfluidique pour miniaturiser les workflows en biologie cellulaire. Ils ont étendu la technique dans le présent travail pour former des arrangements microfluidiques autour de cellules adhérentes pré-plaquées, suivis d'une variété d'essais de preuve de principe sur le clonage cellulaire, dépistage médicamenteux et cicatrisation. La plate-forme présente de nombreux avantages et peut remplacer le mode conventionnel des dispositifs microfluidiques préfabriqués en tant qu'alternative flexible et personnalisable. Les nouveaux arrangements microfluidiques contribuent de manière rentable à la science frugale et peuvent être reconfigurés en temps réel au cours d'une expérience pour une polyvalence accrue. Les chercheurs notent les limites de la technique, y compris les agencements restreints en 2D et la fragilité des parois fluides par rapport aux parois pleines. Soitu et al. espérons optimiser et combiner ces caractéristiques et avantages pour fournir une nouvelle plate-forme aux biologistes traditionnels pour explorer la puissance de la microfluidique.
© 2019 Réseau Science X